Die Geschichte der Katalyse ist praktisch so alt wie die der Chemieindustrie. Auch ohne theoretischen Hintergrund und ohne die Mechanismen zu kennen, lernten die Praktiker früh, dass viele wichtige Reaktionen unter bestimmten Bedingungen schneller ablaufen.

Als eines der ersten Beispiele der industriellen Katalyse gilt das 1746 entwickelte Bleikammerverfahren für die Schwefelsäuregewinnung. Dabei katalysiert Stickstoffdioxid die Oxidation von Schwefeldioxid zu Schwefeltrioxid. Beim im 19. Jahrhundert entwickelten Kontaktverfahren wirkte erst Platin und später Vanadiumpentoxid als Katalysator.
Die Möglichmacher
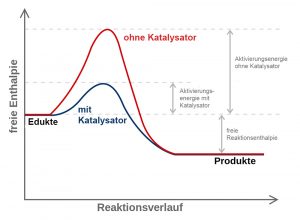
Egal ob Chlor, Salpetersäure, Kunststoffe, Methanol, der blaue Farbstoff Indigo oder das für die Düngemittelherstellung wichtige Ammoniak – bei den Synthesen unzähliger wichtiger Chemikalien sorgen erst Katalysatoren für nennenswerte Umsetzungsgeschwindigkeiten. Eine der frühesten Definitionen der Katalyse stammt von Wilhelm Ostwald, der sich Ende des 19. Jahrhunderts intensiv mit dem Einfluss von Katalysatoren auf chemische Reaktionen beschäftigt hatte. Darin trug er dem Effekt auf die Reaktionsgeschwindigkeit bereits Rechnung.
Später leitete man daraus die bis heute gültige Beschreibung ab, nach der ein Katalysator ein Stoff ist, der die Geschwindigkeit einer chemischen Reaktion erhöht oder den Ablauf einer Reaktion erst ermöglicht, ohne dabei selbst verbraucht zu werden. Ostwald verglich diesen Effekt mit der Wirkung von Schmieröl auf die Räder eines Uhrwerks. In beiden Fällen würden vorhandene Widerstände herabgesetzt: im Uhrwerk der durch die mechanische Reibung, im Chemiereaktor der durch die Energiebarriere. Für seine grundlegenden Arbeiten erhielt Ostwald 1909 den Nobelpreis für Chemie.