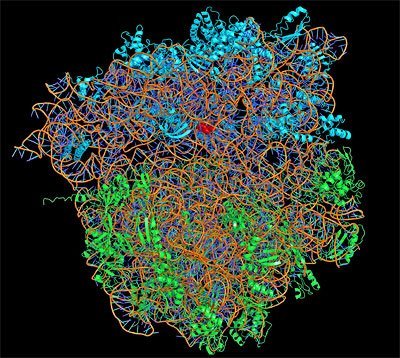
Der diesjährige Chemie-Nobelpreis geht an drei Wissenschaftler, die Struktur und Funktion der Proteinfabrik der Zelle, des Ribosoms, entschlüsselten. In ihm werden die Informationen des Erbguts in Proteine übersetzt und damit erst umsetzbar gemacht. Venkatraman Ramakrishnan, Thomas A. Steitz und Ada E. Yonath eröffneten mit Hilfe der Röntgenkristallographie die entscheidenden Einblicke in dieses Zellorganell.
Jede Zelle unseres Körpers enthält DNA-Moleküle, die Träger des Erbguts. Sie bestimmen, wie unsere Zellen, Gewebe und Organe sich entwickeln. Aber das DNA-Molekül allein ist passiv, nur mit ihm wären wir nicht lebensfähig. Entscheidend ist eine Maschinierie in den Zellen, die aus dieser Blaupause voller Informationen konkrete Werkzeuge des Stoffwechsels, die Proteine, herstellt: das Ribosom. In ihm werden Kopien der DNA-Sequenz, die messenger-RNAs abgelesen und Aminosäure für Aminosäure in das jeweils kodierte Protein übersetzt.
Die so entstehenden Proteine bilden die Basis für unsere Existenz, sei es als Sauerstoff-transportierendes Hämoglobin im Blut, als Antikörper unseres Immunsystems, als Hormon oder Enyzm oder aber als Kollagen in unserer Haut. Um jedoch diese Proteinbildung und auch viele Krankheiten zu vestehen und beklämpfen zu können, ist eine genaue Kenntnis der Vorgänge im Ribosom entscheidend. Und genau dazu trugen die diesjährigen Nobelpreisträger bei.
Der mühsame Weg zum perfekten Kristall
Ada Yonath, heute am Weizmann Institute of Science in Rehovot, Israel, begann schon in den 1960er Jahren an der Möglkichkeit zu arbeiten, die Struktur des Ribosoms mittels der Röntgenkristallographie abzubilden. Bei diesem Verfahren wird eine Probe kristallisert und mit Röntgenstrahlen beschossen. Die Kristalle absorbieren und streuen die Strahlen unterschiedlich stark, eine Fotoplatte hinter der Probe registriert diese Veränderungen.