Frankfurter Wissenschaftler sind bei der Erforschung von Alzheimer einen entscheidenden Schritt weiter gekommen. Wie die Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS) berichtet, haben sie einen Teil der Struktur von Presenilin entschlüsselt. Das Enzym spielt eine wichtige Rolle bei der Entstehung der Vorstufen der Plaques im Gehirn von Alzheimer-Kranken.
Mit zunehmender Lebenserwartung in den Industrieländern steigt auch die Zahl der Demenz-Erkrankungen. Zu 60 Prozent gehen diese auf die Alzheimer’sche Krankheit zurück, die durch den Verlust bestimmter Neuronen in der Großhirnrinde verursacht wird. Verantwortlich dafür sind, so der derzeitige Kenntnisstand, nicht die sichtbaren Ablagerungen oder Plaques im Gehirn, sondern deren Vorstufen. Das sind kürzere kleinere Proteinaggregate aus dem Beta-Amyloid-Peptid. Gelingt es, deren Entstehung zu verhindern, sollte die Krankheit nicht auftreten. Doch wie und wo kann man in diesem Prozess eingreifen?
Struktur von Presenilin auf der Spur
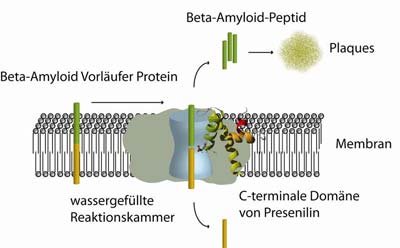
Bisher wusste man nur, dass das Enzym mit dem Namen „Presenilin“ an der Entstehung von Beta-Amyloid-Peptid beteiligt ist. Wie es genau funktioniert, war unbekannt, weil die Struktur des wasserunlöslichen Proteins mit herkömmlichen Methoden nicht zugänglich war.
Um biologische Strukturen mit den herkömmlichen Methoden der Molekularbiologie aufklären zu können, müssen sie wasserlöslich sein und in ausreichenden Mengen zur Verfügung stehen. Beides trifft auf das Presenilin nicht zu, weil es in der Lipidschicht der Zellmembran verankert ist.
Erfolgreiche Experimente
Daher mussten die Wissenschaftler sich bisher auf Computersimulationen verlassen. Diese sagten aber zumindest für eine Teilstruktur des Enzyms unterschiedliche Wirkmechanismen voraus. Dem Team um Professor Volker Dötsch vom Institut für Biophysikalische Chemie der Goethe Universität und dem Frankfurt Institute of Molecular Life Sciences (FMLS) ist es nun gelungen, die Struktur dieses entscheidenden Teils des Presenilins experimentell aufzuklären.
Es benutzte dabei ein seit mehreren Jahren am Institut entwickeltes Verfahren zur Herstellung von Membran-Proteinen, bei dem die zelluläre Maschinerie zur Proteinsynthese im Reagenzglas isoliert wird. Die Mitarbeiter des Institutes um Frank Bernhard konnten mit diesem Trick die für detaillierte Strukturuntersuchungen benötigten großen Mengen an Membran-Proteinen gewinnen.
Aminosäure sitzt in der Membran
Anschließend bestimmten die Forscher die Struktur des Teilstücks von Presenilin mithilfe der NMR-Spektroskopie. Die Daten ließen erkennen, dass die Aminosäure, die an dem Zerschneiden des Beta-Amyloid-Vorläufer-Proteins beteiligt ist, tatsächlich mitten in der Membran sitzt. Weil Proteasen ihre Arbeit nur in wässriger Umgebung verrichten können, hatte man früher angenommen, dass es erst zu einer Verletzung der Membran kommen muss.
Weitere Untersuchungen der Frankfurter Forscher zeigten allerdings, dass die betreffende Aminosäure wahrscheinlich an der Ausbildung einer wassergefüllten Aushöhlung innerhalb der Membran beteiligt ist. Darauf hatte es bereits Hinweise in elektronenmikroskopischen Aufnahmen gegeben. Die nun ermittelte Struktur des C-terminalen Teils von Presenilin zeigt darüber hinaus zum Teil recht ungewöhnliche Strukturen, wie Helices, die parallel zur Membran-Oberfläche liegen.
„Das könnte erklären, warum die Strukturvorhersage so schwierig war“, meint Dötsch, „Interessanterweise existieren in einer bakteriellen membrangebundenen Protease (GlpG) ähnliche Strukturelemente. Die nun in Presenilin identifizierten Strukturen könnten für die ganze Klasse der membrangebundenen Proteasen charakteristisch sein“.
Großes Puzzlespiel
Bis diese Struktur zur Entwicklung von Medikamenten für die Behandlung von Alzheimer Patienten führen wird, sind Dötsch zufolge noch viele Einzeluntersuchungen notwendig: „Es ist wie beim Zusammenfügen eines großen Puzzles: die jetzt ermittelte Struktur ist nur ein kleiner, aber wichtiger Teil darin. Sie stellt gewissermaßen einen Teil des Zentralmotivs dar.“
(idw – Goethe-Universität Frankfurt am Main, 04.05.2010 – DLO)