Durch „Protein-Engineering“ haben Forscher erstmals eine virale Genfähre konstruiert, die gezielt Gene nur in bestimmte Zelltypen einschleust. Dies könnte sich als entscheidender Durchbruch für die Gentherapie erweisen, da unspezifische Gentransfers hier vielfach gefährliche Nebenwirkungen und Spätfolgen auslösen. Die neue, jetzt in „Nature Methods“ vorgestellte Genfähre ist nicht nur hochselektiv, sondern auch noch vielseitig einsetzbar. So sind nur kleine Veränderungen nötig, um sie für so verschiedene Zellen wie Blutstammzellen, Lymphozyten oder Neurone zu nutzen.
Mutierte Gene durch intakte ersetzen – das Ziel der Gentherapie ist klar definiert. Mit Vektoren aus Lentiviren, einer Untergruppe von Retroviren, lassen sich zwar auch schon bisher Gene in Zellen einschleusen. Doch diese Genfähren können zwar Gene sehr effizient übertragen, dabei aber nicht zwischen verschiedenen Zelltypen unterscheiden. Sie sind nicht selektiv. „Dies liegt daran, dass sich Viren im Laufe von Jahrmillionen optimal an ihren Wirt angepasst haben und für den Zelleintritt Rezeptoren nutzen, die auf vielen Zellytpen vorhanden sind“, erläutert Professor Klaus Cichutek, Präsident und Leiter der Abteilung Medizinische Biotechnologie des Paul-Ehrlich-Instituts.
Hüllproteine des Masernvirus modifiziert
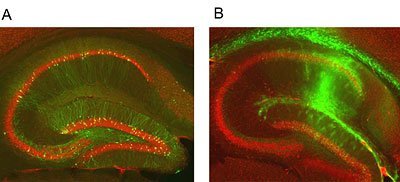
Forscher des Paul-Ehrlich-Instituts gemeinsam mit nationalen und europäischen Kollaborationspartnern haben jetzt die Hüllproteine eines Masernvirus so verändert, dass sie in lentivirale Vektoren eingebaut werden können. Dadurch werden diese weitaus spezifischer als bisher. Dies gelang erst durch „Protein-Engineering“ – die gezielte Verkürzung der Proteine – gelang dies den Wissenschaftlern. In einem zweiten Schritt veränderten die Forscher eines der beiden Hüllproteine – das Hämagglutinin-Protein – so, dass es jetzt nicht mehr an den Rezeptor binden kann, der auf vielen menschlichen Zellen vorhanden ist.
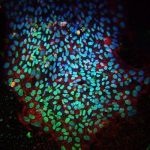
Wie aus Schlüsselrohlingen durch Einfräsen von Zacken der passende Schlüssel für ein Schloss gemacht wird, so wandeln Professor Christian Buchholz und seine Mitarbeiter durch das Anheften kleiner Antikörperfragmente ihren „Rohling“ zu Präzisionsfähren um. Die Antikörperfragmente passen nun zu charakteristischen Markern auf Zellsubtypen wie der Schlüssel ins Schloss. Damit binden die neuen Genfähren nun ganz spezifisch beispielsweise an Zellen des Nervensystems oder an Blutstammzellen.