Vom EPO-Gen zum HIF-Komplex
Den Anfang machte Anfang der 1990er Jahre Gregg Semenza von der Johns Hopkins University in Baltimore. Als er die Genregulation für das EPO-Gen untersuchte, fand er heraus, dass diese direkt vom Sauerstoffgehalt der Zellumgebung beeinflusst wird. Zudem stellte er – gleichzeitig mit William Ratcliffe von der University of Oxford in Großbritannien – fest, dass es einen eng mit dem EPO-Gen verknüpften Sensormechanismus geben muss, der in allen Zellen und Geweben aktiv ist.
Auf der Suche nach diesem Sensor entdeckte Semenza zunächst einen Genabschnitt direkt neben dem EPO-Gen, der offenbar für die sauerstoffabhängige Reaktion verantwortlich war. Bei in Kultur gehaltenen Leberzellen fand der Forscher dann heraus, dass ein spezieller Proteinkomplex an dieses DNA-Segment bindet – und dass dieser Hypoxia Inducible Faktor Alpha (HIF-α) genannte Komplex die Genreaktion auf den Sauerstoffgehalt kontrolliert.
Damit war das erste Puzzleteil im zellulären Sauerstoffsensor gefunden. Weitere Untersuchungen enthüllten, dass HIF-α bei genügend Sauerstoff nicht lange stabil bleibt. Herrscht jedoch Sauerstoffmangel, stoppt dieser Abbau und der Gehalt dieses Proteinkomplexes in der Zelle steigt an. Das wiederum wirkt dann auf die Genregulation.
Krebsgen mit Nebenwirkungen
Das nächste Puzzleteil entdeckte 1995 William Kaelin am Dana-Farber Cancer Institute in Boston – fast durch Zufall. Denn eigentlich suchte der Krebsforscher nach der genetischen Basis einer ererbten Krebsneigung, der sogenannten Hippel-Lindau-Krankheit. Dabei stieß Kaelin auf das VHL-Gen, das in seiner mutierten Form nicht nur die Tumoranfälligkeit von Zellen beeinflusst, sondern auch die Expression von Genen, die mit der Sauerstoffverfügbarkeit verknüpft sind.
Kaelin und sein Team gingen diesem „Nebeneffekt“ nach und entdeckten eine Verbindung zum HIF-α: Das vom VHL-Gen produzierte Protein kann demnach direkt mit dem HIF-Proteinkomplex interagieren und fördert den Abbau des HIF-Moleküls bei ausreichender Sauerstoffversorgung. Die Aktivität des VHL-Gens steuert demnach, wie anfällig das HIF-α gegenüber einer Degradation ist – aber wie?
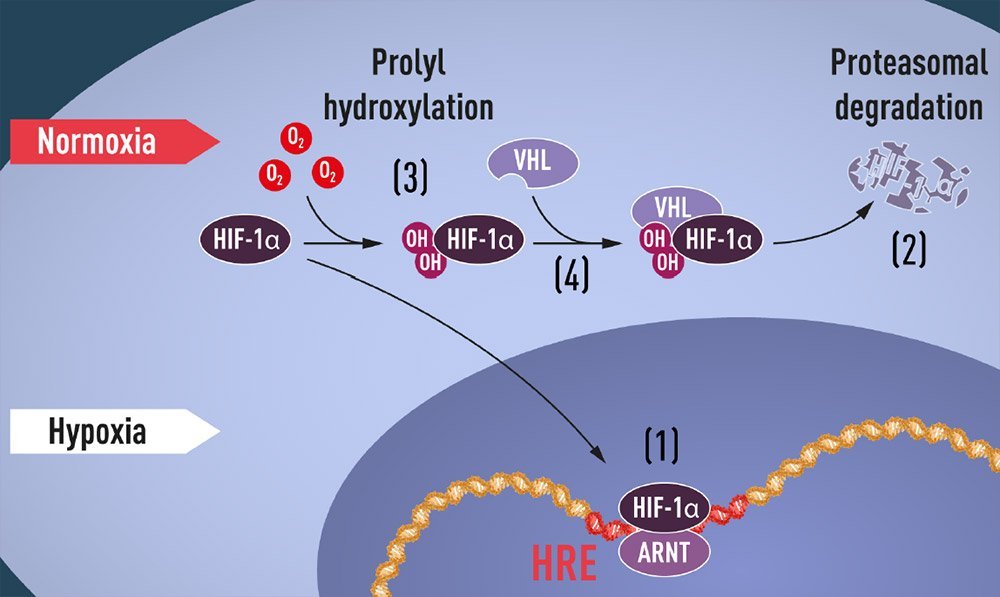
Zentraler Akteur bei der zellulären Reaktion auf Sauerstoffmangel ist der Proteinkomplex HIF-alpha. Er wird bei genügend O abgebaut, reichert sich aber bei Sauerstoffmangel an und beeinflusst die Genregulation (unten). © Nobelprize.org
Abbaumarker in Schlüsselposition
Sowohl Kaelin und sein Team als auch Ratcliffes Forschergruppe in England gingen dieser Frage nun parallel nach. 2001 dann hatten beide die Antwort gefunden: Unter normalen Bedingungen mit ausreichend Sauerstoff wird das HIF-α auf spezielle Weise markiert: Es bekommt zwei Hydroxylgruppen (-OH) an zwei Stellen seines Molekülgerüsts angehängt. Diese Anhänge wiederum ermöglichen es dem VHL-Protein anzudocken und das HIF-Molekül so für spezielle Abbauenzyme zu markieren.
Leidet die Zelle dagegen unter Sauerstoffmangel, bleibt diese Markierung aus und der Proteinkomplexx reichert sich im Zellkern an. Dort bindet er an spezielle Genabschnitte und aktiviert so die genetische Reaktion der Zelle auf die Hypoxie.
Fundamentaler Mechanismus entschlüsselt
Zusammen haben alle drei Forscher so dazu beigetragen, den komplexen Mechanismus zu entschlüsseln, über den die Zelle sich an verschiedene Sauerstoffgehalte anpassen kann. Ratcliffe, Kaelin und Semenza haben gezeigt, dass und wie sich die Genaktivität verändert, wenn Sauerstoff knapp wird oder aber reichlich vorhanden ist.
Damit haben die drei Nobelpreisträger einen fundamentalen Mechanismus erhellt, der in allen unseren Zellen vorkommt. Erst er ermöglicht es beispielsweise unseren Muskeln, sich auch bei großer Anstrengung weiter zu bewegen. Gleichzeitig erklärt er auch, wie sich Menschen an das Leben in großen Höhen anpassen konnten oder wie sich Zellen unseres Körpers auf plötzlichen Sauerstoffmangel einstellen – beispielsweise bei einem Herzinfarkt oder Schlaganfall.
Quelle: Nobelprize.org
7. Oktober 2019
- Nadja Podbregar