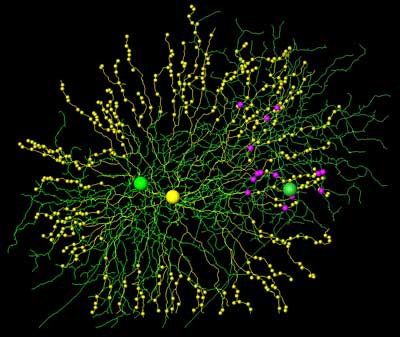
Damit das Auge die Eigenschaften optischer Reize effizient an das Gehirn weiterleiten kann, werden diese Informationen bereits im Auge vorverarbeitet. Manche der so genannten Ganglionzellen, die die Sehinformation über den Sehnerv ins Gehirn leiten, reagieren beispielsweise nur auf Lichtreize, die sich in eine bestimmte Richtung bewegen. Diese Richtungsselektivität wird durch hemmende Interneurone erzeugt, die mit ihren Synapsen die Aktivität der Ganglionzellen beeinflussen. Forscher haben nun mittels einer neuen Mikroskopiemethode herausgefunden, dass die Synapsen zwischen Ganglionzellen und Interneuronen nach ganz speziellen Regeln verteilt sind.
Mit einer Ganglienzelle verbinden sich den Wissenschaftlern des Max-Planck-Instituts für medizinische Forschung in Heidelberg zufolge nur solche Dendriten-Fortsätze, die entgegengesetzt der bevorzugten Richtung der Ganglionzelle vom Zellkörper der Amakrinzelle ausgehen. Die Forscher berichten über ihre Ergebnisse in der aktuellen Ausgabe des Wissenschaftsmagazins „Nature“.
Interneurone und Ganglionzellen
Die Sinneszellen in der Netzhaut des Wirbeltier-Auges wandeln Lichtreize in elektrische Signale um und leiten sie über nachgeschaltete so genannte Interneurone zu den Ganglionzellen und von dort ins Gehirn. Die Interneurone sind so miteinander verschaltet, dass die einzelnen Ganglionzellen Sehinformation von einem kreisförmigen Ausschnitt des Sehfeldes erhalten – dem so genannten rezeptiven Feld.
Manche Ganglionzellen werden beispielsweise nur aktiviert, wenn Licht auf das Zentrum ihres rezeptiven Feldes fällt, die Peripherie dagegen dunkel bleibt (ON-Zellen). Bei anderen ist es genau umgekehrt (OFF-Zellen). Darüber hinaus gibt es Ganglionzellen, die von Licht aktiviert werden, das in einer bestimmten Richtung über ihr rezeptives Feld streicht. Im Gegensatz zu dieser Vorzugsrichtung hemmt eine Bewegung in entgegen gesetzter Richtung (Nullrichtung). Eine wichtige Rolle für diese Richtungsselektivität spielen „Starburst“-Amakrinzellen, die die Aktivität der Ganglionzellen über hemmende synaptische Verbindungen modulieren.
Bewegte Reize aktivieren Starburst-Amakrinzellen
Schon vor einigen Jahren hatte dieselbe Arbeitsgruppe am Heidelberger Max-Planck-Institut gezeigt, dass Starburst-Amakrinzellen von bewegten Reizen aktiviert werden. Dabei reagiert jeder Ast des runden Dendritenbaums auf solche Reize bevorzugt, die sich vom Zellkörper entlang nach außen bewegen. Bewegungen von außen nach innen wiederum hemmen ihre Aktivität. Ihre Dendriten fungieren dabei im Zentralbereich rund um den Zellkörper klassisch als Empfänger von elektrischen Signalen, im Randbereich dagegen auch als Sender – sie entsprechen dort also dem Axon einer Nervenzelle. Ob sie den Ganglionzellen ihre Richtungsselektivität verleihen oder ob die Ganglionzellen ihre Vorzugsrichtung aus anderen Faktoren „errechnen“, war bislang unklar.
Die Max-Planck-Forscher Kevin Briggman, Moritz Helmstaedter und Winfried Denk haben nun entdeckt, dass die Synapsen zwischen Ganglionzellen und Starburst-Amakrinzellen asymmetrisch verteilt sind – obwohl die Zellen selbst symmetrisch sind. Und zwar so, dass von der Ganglionzelle aus gesehen die mit ihr verbundenen Starburstzell-Dendriten entgegen der bevorzugten Bewegungsrichtung eines Lichtreizes laufen.
„Ganglionzellen bevorzugen Amakrinzellen, deren Dendriten entlang der Nullrichtung verlaufen“, sagt Denk.
Laterale Hemmung überflüssig
Früheren Studien von Denk und seinem Team zufolge sind dafür die elektrischen Eigenschaften der sternförmig vom Zellkörper abzweigenden Dendriten der Amakrinzellen entscheidend. Sie werden demnach vom Zentral- zum Randbereich hin immer leichter erregbar, so dass Reize in dieser Richtung bevorzugt weiter geleitet werden. Hemmende Einflüsse zwischen benachbarten Amakrinzellen, die so genannte laterale Hemmung, sind für diesen Mechanismus nicht notwendig.
„Eine Ganglionzelle kann also zwischen Bewegungen unterschiedlicher Richtung unterscheiden, indem sie ausschließlich mit bestimmten Starburst-Amakrinzell-Dendriten Verbindungen eingeht – nämlich denen, die mit ihren hemmenden Synapsen verhindern, dass die Ganglionzelle in Nullrichtung aktiviert wird. Das sind genau die Amakrinzellen, deren Dendriten in dieser Orientierung verlaufen“, erklärt Denk.
Analyse von Funktion und Struktur
Möglich wurden dieser Befund nach Angaben der Wissenschaftler durch eine Kombination zweier unterschiedlicher Mikroskopie-Methoden: Mit einem Zwei-Photonen-Fluoreszenz-Mikroskop bestimmten die Forscher zunächst die bevorzugte Bewegungsrichtung der Ganglionzellen. Ein Kalzium-sensitiver Fluoreszenz-Farbstoff zeigte an, bei welchen Lichtreizen Kalzium in die Zellen einströmt, was die elektrische Aktivität der Zellen signalisiert.
Als nächstes maßen sie den exakten Verlauf aller Dendriten dieser Ganglionzellen sowie die der Amakrinzellen mit Hilfe eines neuen Elektronenmikroskopie-Verfahrens, der seriellen Oberflächenabbildung. Bei diesem Verfahren wird eine Volumenabbildung erstellt, indem wiederholt die Oberfläche eines Gewebepräparats mit dem Elektronenstrahl eines Raster-Elektronenmikroskops abgetastet wird, wobei zwischen den Abtastvorgängen jeweils ein dünnes Scheibchen der Oberfläche mit einem sehr scharfen Diamantmesser „abgehobelt“ wird. Diese Scheibchen sind dünner als ein 25 Nanometer, gerade mal ein tausendstel der Dicke eine menschlichen Haares.
Synapsen eindeutig identifiziert
Die hohe dreidimensionale Auflösung dieses Verfahrens erlaubt es den Wissenschaftlern zufolge, die gerade in der Netzhaut des Auges dicht gepackten verästelten Fortsätze der Nervenzellen zu verfolgen und die Synapsen zwischen ihnen eindeutig zu identifizieren.
Die vollständige Automatisierung der Bildaufnahme macht es möglich über Wochen hinweg Datensätze mit tausenden oder gar zehntausenden von Schnitten aufzunehmen, „während man selbst z.B. im Urlaub oder auf Dienstreise ist“ sagt Denk. „Daher ist nun erstmals möglich, winzige Zellstrukturen mit hoher Auflösung in einem größeren Gewebestück zu beobachten. Dieses Verfahren wird deshalb künftig unverzichtbar sein, um Verschaltungsmuster auch in anderen Regionen des Nervensystems zu aufzuklären.“ (Nature, 2011; doi:doi:10.1038/nature09818)
(MPG, 15.03.2011 – DLO)