Eine effektive Müllentsorgung ist nicht nur in der menschlichen Gesellschaft sondern auch im Körper aller Organismen wichtig. Jetzt haben Wissenschaftler herausgefunden, wie Bakterien ihren Proteinmüll in der Zellhülle unschädlich machen: Ein wie ein kleiner Käfig geformtes Enzym zerlegt die Moleküle in ungefährliche Bruchstücke.
Defekte und überzählige Proteine in und außerhalb von Zellen können extrem gefährlich für den Organismus sein. Da Proteine, die Ihre Funktionstüchtigkeit verloren haben, dazu neigen mit anderen Eiweißmolekülen zu großen Aggregaten zu verklumpen, können sie die lebenswichtigen Zellfunktionen erheblich stören. In den verschiedenen Bereichen der Zelle und auch außerhalb der Zelle gibt es deshalb spezielle Enzyme, die den Eiweißschrott erkennen und unschädlich machen: die sogenannten Proteasen.
Sowohl bei den kleinsten einzelligen Organismen wie beispielsweise Bakterien als auch beim Menschen gibt es eine ganze Gruppe von diesen Müll-Entsorgungs Molekülen. Ist die Funktion von Proteasen lahmgelegt, so kann dies zu schwerwiegenden Erkrankungen wie Parkinson oder Alzheimer führen. Während die Arbeitsweise von vielen Proteasen innerhalb der Zelle gut charakterisiert ist, ist die Qualitätskontrolle von Proteinen außerhalb der Zelle noch wenig erforscht.
Enzym erkennt „gute“ und „schädliche“ Proteine
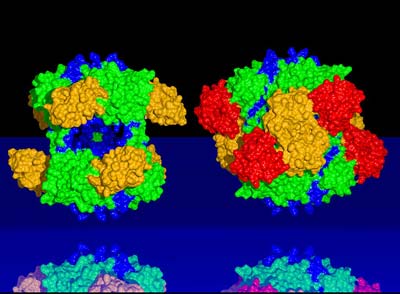
Ein Team von Forschern aus Wien, Martinsried, Cardiff und Duisburg- Essen hat jetzt die Protease Funktion von DegP untersucht, welches in der Zellhülle von Bakterien, also außerhalb der Zelle, eine wesentliche Rolle bei der Entsorgung von defekten Proteinen spielt.