Innerhalb welcher Grenzen von Temperatur und Druck Proteine stabil sind, haben jetzt Wissenschaftler systematisch bestimmt und dadurch erstmals eine „Naturkonstante“ der Proteinfaltung ermittelt. Ähnlich wie die Elementarladung oder das Planck’sche Wirkungsquantum in der Physik wird die dabei entdeckte Gesetzmäßigkeit in den Biowissenschaften helfen, die dreidimensionale Struktur und Stabilität von Eiweißstoffen zu verstehen und vorherzusagen, so die Forscher in der Fachzeitschrift Proceedings of the National Academy of Sciences (PNAS).
{1l}
Proteine sind die Grundlage des Lebens: Sie sorgen als Enzyme für den Stoffwechsel, sie steuern Wachstum und Kommunikation von Zellen und Lebewesen, sie formen Hüllen und Gerüststrukturen, und sie bewirken die Abwehr von Krankheitserregern. Proteine bestehen aus Ketten von Aminosäuren. Um ihre Funktion ausüben zu können, müssen diese Aminosäureketten in einer bestimmten Weise räumlich gefaltet sein.
Bei Hitze oder starkem Druck bricht diese Faltung auf – und damit erlischt die biologische Aktivität. Bei der Konservierung von Lebensmitteln ist das nützlich: Milch und rohes Fleisch werden durch Hitze keimfrei und damit länger haltbar, und einige Lebensmittelunternehmen sterilisieren heute Grapefruitsaft und Kochschinken mit Überdruck.
In einem Forschungsprojekt der Technischen Universität München (TUM) haben jetzt der Physiker Professor Josef Friedrich und der Biochemiker Professor Arne Skerra vom Wissenschaftszentrum Weihenstephan zusammen mit ihren Teams grundlegend untersucht, unter welchen Temperatur- und Druckverhältnissen Proteine noch gefaltet sind.
Mini-Schnellkochtopf im Einsatz
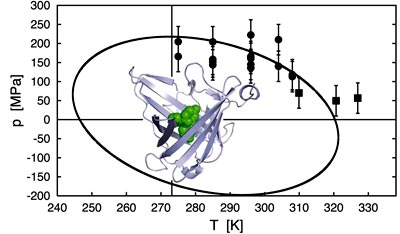
Dazu benutzten die TUM-Forscher eine Art Mini-Hochdruck-Schnellkochtopf, einen Diamanten mit einem winzigen Hohlraum von knapp einem halben Millimeter Durchmesser, in dem sich hohe Drücke einstellen und die Temperatur präzise verändern lassen. Als Untersuchungsobjekt diente ein Protein aus der Klasse der Anticaline, das in seiner kelchförmigen Tasche einen Farbstoff bindet. Entfaltet sich das Protein, wird der Farbstoff freigesetzt und beginnt zu fluoreszieren. Dieses Leuchten in dem winzigen Hohlraum des Diamanten konnten die Wissenschaftler mit einem hochempfindlichen Instrument messen.
Die systematischen Messreihen mit diesem maßgeschneiderten Modellsystem erlaubten fundamentale Einblicke in die Biophysik derProteinfaltung: Durch mathematische Ableitungen, ausgehend von den Gesetzmäßigkeiten der Thermodynamik, bestimmten die TUM-Forscher erstmals die Naturkonstante der Proteinfaltung. Sie konnten beweisen, dass sich Proteine nicht nur bei hohen Temperaturen und Drücken, sondern auch bei negativen Temperaturen und – soweit erreichbar – „negativen Drücken“ entfalten. Daraus ergab sich die Schlussfolgerung, dass Proteine ganz allgemein innerhalb eines ellipsenförmigen Bereichs des Druck/Temperatur-Diagramms gefaltet sind.
Rätsel um Proteinfaltung lösen
Auch wenn es schon aus früheren Untersuchungen entsprechende Hinweise gab, konnten die Weihenstephaner Wissenschaftler dieses biomolekulare Verhalten erstmals in allgemeiner Form bestätigen und vor allem eine theoretische Begründung dafür liefern, dass es sich zwangsläufig aus der physikalischen Natur der Proteine ergibt.
Langfristig, so glauben die TUM-Forscher, wird diese Entdeckung dabei helfen, das bislang in der Biochemie ungelöste Problem der Proteinfaltung zu knacken. Darüber hinaus ergeben sich mögliche praktische Anwendungen zum Beispiel bei der Stabilisierung von Waschmittel- oder Lebensmittelenzymen bei hohen oder niedrigen Temperaturen, oder bei der Behandlung von Proteinfaltungskrankheiten wie der Creutzfeldt-Jakob-Krankheit, der Alzheimer-Erkrankung oder dem „Rinderwahnsinn“ BSE.
(idw – Technische Universität München, 11.04.2008 – DLO)