Ribosomen sind die „Proteinfabriken“ der Zelle. An ihnen werden die einzelnen Aminosäuren entsprechend einer „Bauanleitung“ aus dem Zellkern, der Boten-RNA, zu kompletten Proteinen zusammengesetzt. Einen neuen Einblick in den Entstehungs- und Reifungsmechanismen einer der Ribosomenteile haen jetzt Wissenschaftler gewonnen und berichten darüber in der Zeitschrift „Nature“.
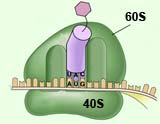
Ribosomen bestehen aus zwei Untereinheiten, der etwas größeren so genannten 60S- und der kleinen 40S-Untereinheit. Noch unreife Vorläufer dieser beiden Einheiten werden im Kern der Zellen produziert und miteinander verbunden. Dann wandern sie ins Zellplasma, wo die Reifung stattfindet. Dabei werden die Vorläufer endgültig zu den funktionsfähigen 60S- und 40S- Untereinheiten umgebaut.
Jetzt konnte zum ersten Mal ein einzelner Reifungsschritt der 40S- Untereinheit im Reagenzglas studiert werden, bei dem die kleine ribosomale Untereinheit ihren typischen "Schnabel" entwickelt. Bei der Ausbildung dieses Strukturelements wurde das ribosomale Protein Rps3, das sich in unmittelbarer Nähe zum Schnabel befindet, fest in die kleine Untereinheit eingebaut.
Zuständig für den Ablauf der Schnabelbildung zur richtigen Zeit und am richtigen Ort ist die Proteinkinase Hrr25, die mit der sich entwickelnden Prä-40S- Untereinheit assoziiert ist und regulierend in diesen Vorgang eingreift.