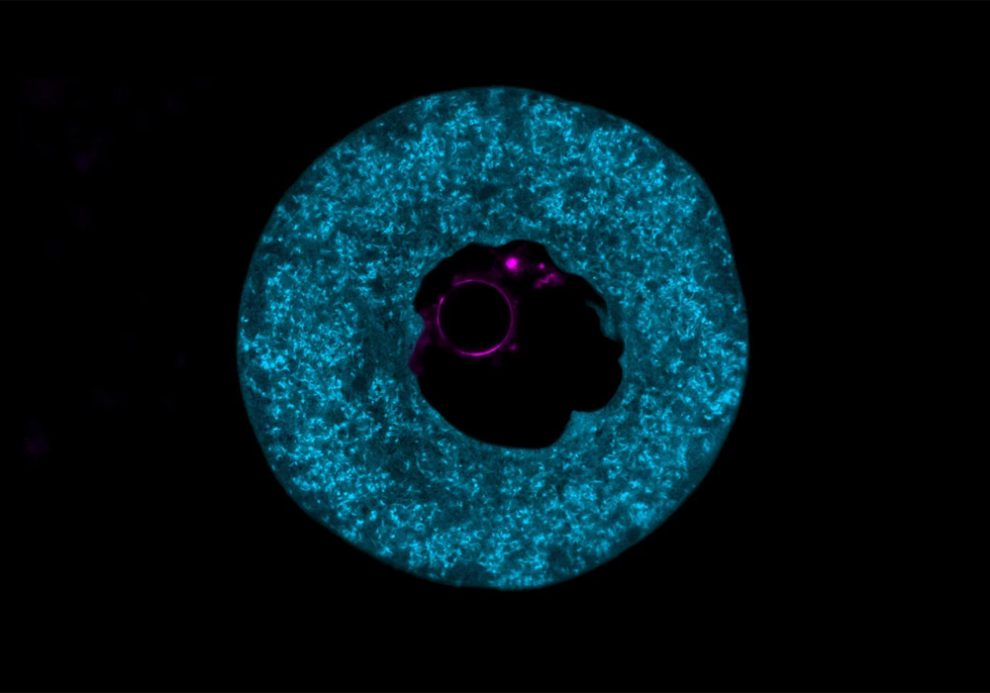
„Die große methodische Herausforderung war es, die Eizellen für unsere verwendeten Bildgebungsverfahren – hochauflösende Lichtmikroskopie und Kryo-Elektronentomografie (Kryo-ET) – zugänglich zu machen“, erklärt Seniorautorin Melina Schuh vom MPI-NAT. „Letztere ermöglicht es, molekulare Strukturen der Eizelle in 3D unter fast natürlichen Bedingungen zu untersuchen. Das war bislang nicht möglich“, ergänzt sie.
Technik aus der Reproduktionsmedizin
Zum Durchbruch bei diesem Verfahren verhalf dem Team nach eigenen Angaben einen Trick aus der Reproduktionsmedizin. Für die Kryo-ET müssen Zellen zunächst schockgefroren werden. Dabei machten sich die Forschenden zunutze, dass Kliniken menschliche Eizellen für künstliche Befruchtung routinemäßig einfrieren, um sie zu lagern. Dabei verwenden sie ein Schutzmittel, um die Eizellen während des Einfrierens zu schützen.
„Wir hatten die Idee, dieselben Schutzmittel zu verwenden, um das erforderliche schnelle Einfrieren der Eizellen zu erreichen“, berichtet Koautor Rubén Fernández-Busnadiego von der Universitätsmedizin Göttingen. „Mit dieser Technik konnten wir die sogenannten zytoplasmatischen Gitter in der Eizelle untersuchen und beginnen, ihre Struktur im Detail zu entschlüsseln“, ergänzt Schuh. Diese Gitter, die das Innere der Eizelle ausfüllen, sind bereits seit den 1960er Jahren bekannt, aber bis heute kaum verstanden.
Proteine sind Bestandteil des Versorgungsnetzes von Eizellen
Nun entdeckten Jentoft und ihre Kollegen, dass das Protein PADI6 und der Proteinkomplex SCMC die Hauptbestandteile dieser Gitterstruktur sind. Die Gene dieser Proteine stehen früheren Erbgutanalysen zufolge im Zusammenhang mit weiblicher Unfruchtbarkeit. In der Studie zeigte sich nun auch, dass das Gitter aus feinen Filamenten mit großer Oberfläche besteht. „Die Forschungswelt rätselt seit Jahrzehnten, welche Funktion und Zusammensetzung diese zytoplasmatischen Gitter haben“, sagt Schuh.
Um dies genauer zu untersuchen, entfernten die Forschenden in Mäuse-Eizellen die PADI6- und SCMC-Proteine. Dabei stellten sie fest, dass dadurch das zytoplasmatische Gitter verloren ging – mit fatalen Folgen: „Mäuse-Eizellen ohne zytoplasmatisches Gitter fehlten auch die Proteine, die der frühe Embryo benötigt. Die Entwicklung des Embryos kam kurz nach der Befruchtung zum Stillstand“, berichtet Schuh. „Wir vermuteten daher, dass die zytoplasmatischen Gitter als Proteinspeicher dienen könnten.“
Woraus besteht das Gitter?
In einem nächsten Schritt untersuchten die Forschenden mithilfe von Massenspektrometrie und Bioinformatik, welche weiteren Proteine in den zytoplasmatischen Gittern enthalten sind. Die Ergebnisse zeigen, dass sich diese mit vielen Proteinen verbinden, die für die Embryonalentwicklung entscheidend sind, beispielsweise, weil sie die Gene regulieren. „Unsere Ergebnisse liefern starke Hinweise darauf, dass unsere Vermutung stimmt: Die zytoplasmatischen Gitter sind die Proteinspeicher der Eizelle und versorgen den frühen Embryo mit lebenswichtigen Proteinen“, sagt Schuh.
Demnach übernehmen die PADI6- und SCMC-Proteine bei der Proteinvorratshaltung in Eizellen von Mäusen und Menschen die Aufgabe, Proteine für die Frühentwicklung des Embryos zu sammeln und zu speichern und so zu verhindern, dass sie frühzeitig abgebaut werden. „Das erklärt, warum Embryos kurz nach der Befruchtung aufhören, sich zu entwickeln, wenn diese Proteine fehlen oder ihre Funktion nicht erfüllen können“, sagt Erstautorin Jentoft.
Wie wichtig sind die Proteine für die Fruchtbarkeit?
Ohne diese Proteine gibt es demnach kein neues Leben. Aber ist das unumgänglich? „Wir haben auch analysiert, ob sich ein defekter Proteinspeicher ersetzen lässt, wenn beispielsweise durch Genmutationen PADI6 und SCMC fehlen“, berichtet Jentoft. Dafür brachten sie und ihre Kollegen in wachsende Eizellen von Mäusen die fehlenden Gitterproteine künstlich wieder ein.
Mit diesem Ansatz ließe sich möglicherweise auch in fehlerhaften menschlichen Eizellen das zytoplasmatische Gitter neu aufbauen. „Dies könne ein neuer, vielversprechender Ansatz sein, um Unfruchtbarkeit zu behandeln, die auf Mutationen der PADI6- und SCMC-Gene beruhen“, meint Jentoft. Von den neuen Techniken erhoffen sich die Forschenden neben zukünftigen neuen Therapieansätzen für Unfruchtbarkeit auch wichtige Fortschritte in der Eizellforschung. (Cell, 2023; doi: 10.1016/j.cell.2023.10.003)
Quelle: Max-Planck-Institut für Multidisziplinäre Naturwissenschaften Göttingen
15. November 2023
- Claudia Krapp