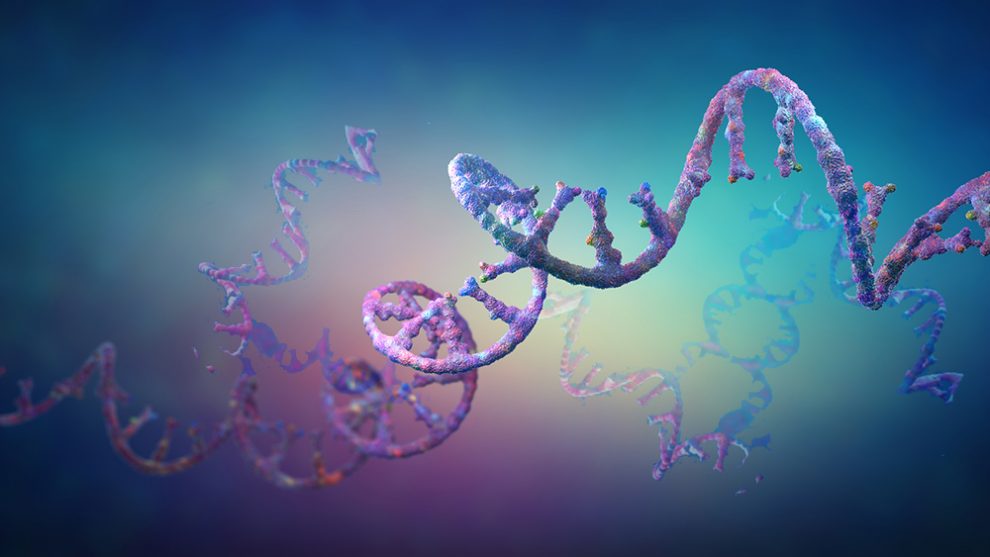
Uranfang des Lebens: Forschende könnten ein entscheidendes Missing-Link der RNA-Welt gefunden haben – der Zeit, in der es auf der Erde noch keine DNA oder Enzyme gab. Denn ihr Experiment belegt erstmals, dass auch pure RNA die Verknüpfung von Aminosäuren zu Peptidketten katalysieren kann. Dies schließt eine wichtige Lücke zur Bildung der ersten Proteine in der „Ursuppe“- und könnte damit das Henne-Ei-Problem der Lebensentstehung lösen, wie das Team in „Nature“ berichtet.
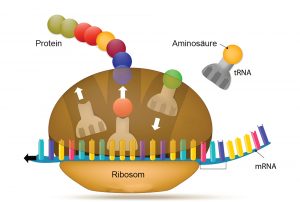
Heute basiert alles irdische Leben auf einer Arbeitsteilung: Die Erbmoleküle RNA und DNA speichern die genetische Information, die Ribosomen konstruieren daraus neue Proteine und die Proteine halten den Stoffwechsel und damit den gesamten Organismus am Laufen. Doch wie war dies am Uranfang des Lebens? Nach gängiger Theorie gab es damals noch keine DNA, Ribosomen oder DNA-kopierende Enzyme. Doch ohne Proteine kann sich die DNA nicht vervielfältigen und ohne Ribosomen gibt es keine Proteine – es ist ein echtes Henne-Ei-Problem.
Fehlendes Puzzleteil der RNA-Welt
Einen möglichen Ausweg bietet die RNA: Anders als die DNA benötigt diese Form des Erbmoleküls keine Proteine, um sich zu vervielfältigen, sondern fungiert als ihr eigenes Enzym. Nach gängiger Theorie stand am Anfang allen Lebens daher eine RNA-basierte Welt – dies löst zumindest einen Teil des Henne-Ei-Problems. Doch offen blieb bisher, wie ohne Ribosomen oder sonstige Proteinfabriken die ersten Eiweiße gebildet werden konnten.
Eine Antwort auf diese Frage könnten nun Felix Müller von der Ludwig-Maximilians-Universität München und seine Kollegen gefunden haben. „In der RNA-Welt muss es irgendwann einen Punkt gegeben haben, an der die RNA die Fähigkeit erlangte, zumindest die Synthese kleinerer Peptide zu katalysieren“, erklären die Forschenden. Sie haben daher nach chemischen Prozessen gesucht, durch die RNA-Moleküle das Aneinanderkoppeln von Aminosäuren zu Peptidketten geschafft haben könnten – ganz ohne Ribosomen und Co.