Wichtige Biokatalysatoren: Forscher haben die Wurzeln jener Enzyme ergründet, die für den Stoffwechsel heutiger Lebewesen unerlässlich sind. Demnach bestanden die ersten Proteine dieser Art womöglich aus nur zwei einfachen Faltstrukturen – und diese Strukturen wiederum scheinen auf einen gemeinsamen Vorfahren zurückzugehen. Dieses urtümliche Peptid könnte das erste metabolisches Enzym in der „Ursuppe“ des Lebens gewesen sein.
Wie und wo das erste Leben entstand, ist noch immer rätselhaft. Forscher vermuten die Wiege des Lebens unter anderem in heißen Tümpeln, an hydrothermalen Schloten oder in den Poren erstarrter Lava von Meeresvulkanen. Auch welche Biomoleküle die ersten Lebensbausteine bildeten, ist bislang strittig. Einer Theorie nach könnten sich vor dem heute vorherrschenden Erbmolekül DNA zunächst RNA-basierte Lebensformen entwickelt haben. Denn RNA benötigt keine zusätzlichen Enzyme für den Aufbau.
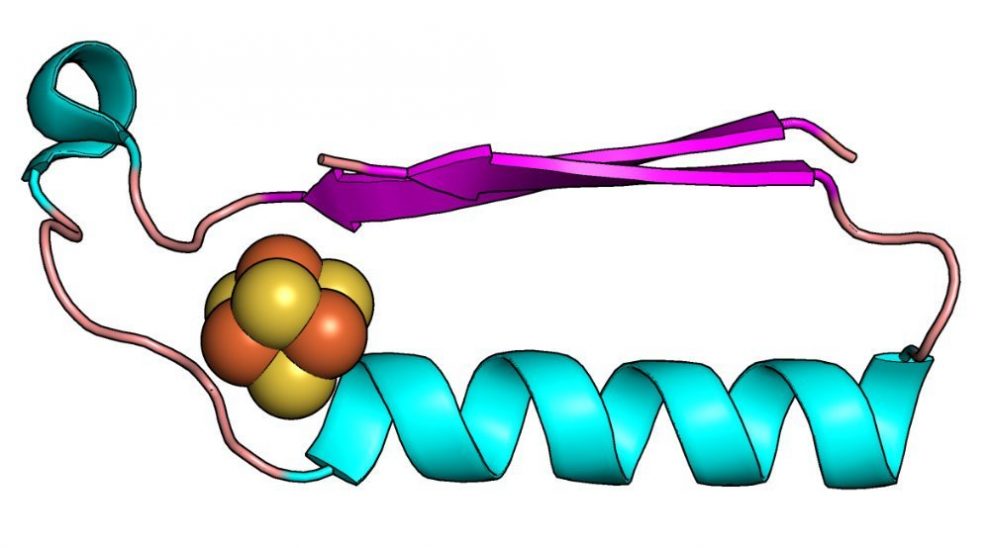
Irgendwann müssen in der „Ursuppe“ aber auch die ersten Proteine dieser Art entstanden sein: „Alles Leben auf der Erde wird von Elektronentransfer-Reaktionen angetrieben. Sämtliche Stoffwechsel im Lebensstammbaum haben zum Beispiel biologische Redoxreaktionen miteinander gemein – und diese Reaktionen werden durch Enzyme katalysiert“, erklären Hagai Raanana von der Rutgers University in Brunswick und seine Kollegen. Konkret handelt es sich bei diesen Enzymen um Vertreter der Oxidoreduktasen.
Proteinstrukturen im Blick
Über den Ursprung und die evolutionäre Entwicklung dieser für das Leben auf der Erde so wichtigen Proteine ist jedoch kaum etwas bekannt. Heutige Oxidoreduktasen sind chemisch und strukturell sehr komplex. „Wir gehen davon aus, dass sich diese Proteine von einem kleinen Satz urtümlicher Strukturen entwickelt haben, die im Laufe der Zeit immer vielfältiger wurden“, sagen die Forscher. Wie könnte dies vonstattengegangen sein?