Angriffspunkt für neue Medikamente
„Dies wäre theoretisch ein interessanter Angriffspunkt für Medikamente. Bisher kann man ihn aber nicht nutzen, wir sind davon zurzeit auch noch weit entfernt. Unsere Arbeit gehört in die Grundlagenforschung“, erklärt der Wissenschaftler. In seinem Team werden die an der Viren-Zell-Bindungsstelle beteiligten Proteine gereinigt, kristallisiert und mit Röntgenstrahlen durchleuchtet. Als Ergebnis erhält der Wissenschaftler eine bis auf die Ebene der Atome genaue dreidimensionale Strukturdarstellung der Interaktion.
Zu den Forschungsobjekten in Stehles Arbeitsgruppe gehören zum Beispiel Adenoviren, die eine Reihe von Infektionen wie Erkältungen oder Magen-Darm-Erkrankungen beim Menschen hervorrufen können. „Infektionen mit Adenoviren sind im Allgemeinen nicht übermäßig gefährlich, aber vor einiger Zeit sind in den USA völlig überraschend eine ganze Reihe von jungen Leuten daran gestorben“, sagt der Wissenschaftler.
Tödlicher Corona-Virus
Auch bei Coronaviren, von denen manche Typen beim Menschen Erkältungssymptome auslösen, sei zumindest ein Fall bekannt – das so genannte SARS-Coronavirus -, in dem von heute auf morgen gefährliche Veränderungen aufgetreten sind, die die Infektion plötzlich tödlich machten.
„Wahrscheinlich konnte man die gefährlichen Viren nur so schnell eindämmen, weil in China die infizierten Menschen radikal isoliert wurden“, vermutet Stehle. Auch von Mäusen sei ein Tumorvirus bekannt, das bei Austausch eines einzigen Proteinbausteins, einer Aminosäure, keine Tumoren mehr auslöst.
Der Forscher ist überzeugt davon, dass manche gefährliche Veränderung bei Viren mit veränderten Bindungseigenschaften zu tun hat, sodass die Viren zum Beispiel neue Gewebetypen angreifen können. Denn die Viren können nicht einfach überall in Zellen eindringen, sondern nur dort, wo sie passende Rezeptoren finden. Daher will Stehle die Viren-Zell-Kontakte eingehend erforschen, um diesen Vorgang in ferner Zukunft für therapeutische Zwecke gezielt stören zu können.
Forscher züchten Kristalle
Die Biochemiker machen eine Strukturanalyse der Viren-Zell-Bindung, die bis auf die Ebene der Atome geht. „Für den ganzen Analyseprozess muss man jeweils zwei bis drei Jahre einkalkulieren“, sagt Stehle. Die Reinigung der an der Bindungsstelle beteiligten Proteine dauere einige Monate. „Daraus züchten wir einen Kristall, der also die Proteine in ganz reiner Form enthält. Es passiert aber oft, dass die Kristalle nicht so wachsen wie gewünscht.“
{3l}
Bei der Züchtung des Kristalls wird dem gereinigten Protein das Wasser entzogen. Der minimal kleine Tropfen muss dann versiegelt und schließlich das Lösungsmittel entzogen werden. Zehn bis 20 Milligramm Proteinkristall werden für die Röntgenuntersuchung gebraucht.
„Wir können all diese Arbeitsschritte hier im Institutsgebäude machen, bis hin zur Röntgenuntersuchung“, sagt Stehle, „allerdings ist es manchmal sinnvoll, noch stärkere Röntgenstrahlen zu nutzen. Im Synchrotron zum Beispiel in Grenoble sind sie bis zu 1000-mal stärker als in Tübingen, dorthin, in die Schweiz oder ans DESY in Hamburg gehen wir öfter mit unseren Proteinkristallen.“
Komplexe Rechnungen erforderlich
Wenn man hochfokussierte Röntgenstrahlen in einen Proteinkristall hineinschießt, werden diese vom Kristall reflektiert, und man erhält auf einem Schirm ein für jeden Proteinkomplex charakteristisches Streumuster. „Um aus diesem Bild auf die Proteinstruktur zurückschließen zu können, sind komplexe Rechnungen notwendig“, erklärt Stehle. Teilweise müssen die Forscher ihre Kristalle allerdings mit Schwermetallen wie Quecksilber oder Uran dotieren, um brauchbare Muster zu bekommen.
„Insgesamt ist die Methode sehr genau“, sagt Stehle. „Und bei den Rechnungen haben wir auch immer wieder Hilfe von anderen Arbeitsgruppen in der Welt über das Internet.“ Die Methode der Röntgenstrukturanalyse verwendeten auch andere Forscher, aber meistens mit einem ganz anderen Forschungsthema, daher gebe es häufig keine direkte Konkurrenz untereinander.
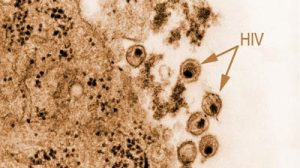
Die dreidimensionalen Darstellungen der Viren-Zell-Kontakte lassen erkennen, wie kompliziert der Bindungsvorgang teilweise ist. Nicht immer handelt es sich um das Prinzip von Schlüssel und Schloss, die genau ineinander passen. Vielmehr finden sich auch Klappmechanismen oder eine Art Zwei-Punkt-Bindung, bei der die zweite Bindung erst möglich wird, wenn die erste schon vollzogen ist. „Letztere Art der Bindung findet sich zum Beispiel beim HI-Virus“, sagt Stehle. „Den Viren-Zell-Bindungsvorgang zu blockieren, hat noch niemand geschafft.“
Virenhemmer im Einsatz
Bisherige Medikamente zur Behandlung von Vireninfektionen beruhten auf anderen Mechanismen. Zum Beispiel verhindern Neuraminidase-Hemmer, die gegen Grippeviren eingesetzt werden, dass die in den eroberten Zellen produzierten Viren freigesetzt werden. Gegen die Aidserreger, die HI-Viren, verwenden Ärzte dagegen so genannte Protease-Hemmer, die ein viruseigenes Werkzeug hemmen. Dadurch fehlen den Viren funktionelle Bauteile, um sich zu vermehren.
„Adenoviren werden übrigens auch in der Gentherapie genutzt als so genannte Vehikel, die gezielt bestimmte Gene in Körperzellen einschleusen“, sagt der Wissenschaftler. Dadurch sollen in der Therapie fehlerhafte Gene repariert werden, die schwere Krankheiten verursachen. „Bisher wird ein Typ der Adenoviren genutzt, der relativ breit verschiedene Gewebe infiziert. Interessant wäre es, Viren als Vehikel zu entwickeln, die ganz spezifisch zum Beispiel nur auf Blutzellen gehen“, sagt Stehle.
Der Wissenschaftler stellt sich vor, dass dies durch ein „Re-Design“ der Virenoberfläche zu erreichen wäre, sodass die Viren nur an ganz bestimmte Rezeptoren binden könnten. Auch dort stehe man aber noch ganz am Anfang der Forschung, sagt er.
Evolution der Viren auf der Spur
Und auch auf einem weiteren Gebiet kann Stehle zusammen mit seiner Arbeitsgruppe mithilfe der Röntgenstrukturanalyse neue Erkenntnisse gewinnen: der Evolution von Viren. „Grundsätzlich können Viren in der Evolution nicht vor Zellen entstanden sein, da sie ohne Zellen gar nicht vermehrungsfähig wären“, sagt Stehle.
Er ist zufällig auf eine interessante Gemeinsamkeit bei Adenoviren und Reoviren, die Durchfälle vor allem bei Kindern verursachen, gestoßen. „Die Reoviren tragen außen ein stacheliges Kugelprotein namens Sigma 1, ein Bindungsprotein, das stark einem Bindungsprotein der Adenoviren ähnelt. Die stacheligen Anhänge haben eine ähnliche Struktur, binden auch teilweise an die gleichen Zellrezeptoren. Die beiden Proteine sind evolutionär verwandt“, sagt er. Dabei gehören die beiden Viren zu zwei ganz unterschiedlichen Familien mit unterschiedlichem Erbgut: das Adenovirus hat ein DNA-Genom, das Reovirus ein RNA-Genom.
Möglicherweise haben die beiden Viren einen gemeinsamen Vorfahren oder sie haben irgendwann untereinander Gene ausgetauscht. „Das kann passieren, wenn zwei Viren dasselbe Gewebe befallen“, erklärt Stehle.
(idw – Universität Tübingen, 06.05.2008 – DLO)
6. Mai 2008