Wissenschaftler haben gezeigt, wie ein spezielles virales Gen den Lebenszyklus von Zellen kontrolliert, die mit dem Epstein-Barr-Virus (EBV) infiziert wurden. Das zugehörige Protein stellt eine wichtige Zielstruktur für die Krebstherapie dar, schreiben die Forscher in der aktuellen Ausgabe der Fachzeitschrift „PLoS Pathogens“.
Die Wissenschaftler der Abteilung Genvektoren des Helmholtz Zentrums München haben in ihrer Studie eine neue Rolle des Gens EBNA-3A bei bösartigen Erkrankungen im Zusammenhang mit EBV entdeckt. „Im Rahmen einer genomweiten Studie konnten wir erstmals Zielgene nachweisen, die durch das zugehörige Protein reguliert werden“, erklärt Dr. Bettina Kempkes, die das Projekt geleitet hat.
95 Prozent der Bevölkerung infiziert
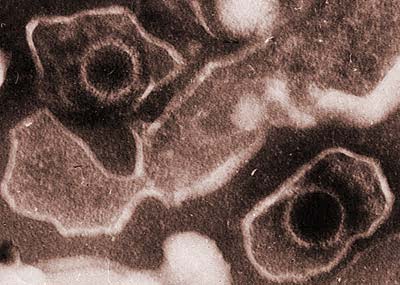
Das Epstein-Barr-Virus (EBV), ein Herpesvirus, ist von großer gesundheitlicher Bedeutung – etwa 95 Prozent der Bevölkerung gelten als latent infiziert. Meist verläuft die Erstinfektion eines gesunden Menschen ohne Symptome; eher selten wird das Pfeiffersche Drüsenfieber mit grippeähnlichen Symptomen ausgelöst. Das Spektrum der Folgekrankheiten nach einer Infektion reicht von gutartigen Vermehrungen der Lymphozyten bis hin zu Krebserkrankungen.
Für Transplantatempfänger, deren Immunsystem medikamentös oder durch Bestrahlung ausgeschaltet werden muss, um Abstoßungen zu verhindern, stellt EBV eine große Gefahr dar. Durch eine Reaktivierung des schlummernden Virus oder auch durch eine Neuinfektion kann die Bildung von bösartigen Erkrankungen des Immunsystems verursacht werden, die als Posttransplantations Lymphome (PTLD) bezeichnet werden. Die EBV-infizierten Zellen zeigen dann ein charakteristisches Expressionsprofil sowohl viraler als auch zellulärer Gene.
Unbegrenzte Vermehrung
Ruhende menschliche B-Zellen können durch EBV-Infektionen aktiviert und transformiert werden. Damit gewinnen sie die Fähigkeit, sich in der Zellkultur unbegrenzt zu vermehren. Bei solchen transformierten B-Zellen laufen sehr ähnliche virale und zelluläre Programme ab wie in bösartig veränderten B-Zellen bei Transplantat-Empfängern. All diese Prozesse werden von neun Genen mit verschiedenen Funktionen in einer konzertierten Aktion gesteuert. Der individuelle Beitrag viraler Proteine zu dem komplexen Prozess kann durch gezielte Inaktivierung einzelner Gene im viralen Genom untersucht werden.
In der Abteilung Genvektoren wurde von Professor Dr. Wolfgang Hammerschmidt und seinem Team bereits 1998 eine Technologie entwickelt, die es ermöglicht, das sehr große Genom des EBV in Bakterienzellen gezielt zu verändern. Mit dieser Technik haben die Forscher um Kempkes jetzt das EBNA-3A-Gen im viralen Genom ausgeschaltet.
Wichtiges Zellkultursystem
So genannte Transformationsstudien mit diesen neuen Viren zeigten, dass EBNA-3A maßgeblich an der Regulation zahlreicher Gene beteiligt ist, die biologische Prozesse wie die Apoptose – den programmierten Zelltod – oder die Regulation des Zellzyklus kontrollieren. Die Störung dieser beiden Vorgänge ist häufig die Ursache für das unkontrollierte Wachstum von Krebszellen.
Dazu Kempkes: „EBNA-3A-negative B-Zelllinien werden in Zukunft ein wichtiges Zellkultursystem darstellen. Damit können wir untersuchen, ob sich das vielversprechende Protein EBNA-3A als Zielmolekül für die Therapie EBV-assoziierter Erkrankungen eignet.“
(Helmholtz Zentrum München, 22.10.2009 – DLO)