Wie der Körper dafür sorgt, dass unsere Fingerglieder alle die richtige Länge erhalten, war bisher nicht bekannt. Jetzt haben Wissenschaftler herausgefunden, dass ein spezielles „Signalzentrum“ vor jedem Fingerglied die Bindegewebszellen des Embryos dazu anregt, sich erst zu Knorpel- und dann zu Knochenzellen umzuwandeln und so das Längenwachstum der Finger voran zu treiben. Wie die Forscher in der Fachzeitschrift „Proceedings of the National Academy of Sciences.“ (PNAS) beschreiben, gibt dies auch Einblicke in die Entstehung von Fehlbildungen der Finger.
Die menschliche Hand ist ein Kunstwerk. Wohl jeder hat schon einmal die Virtuosität eines Klavierspielers bewundert, dessen Finger sich mit fast unglaublicher Geschicklichkeit und Präzision über die Tasten bewegen. Die außerordentlichen mechanischen Leistungen menschlicher Hände beruhen auf der individuellen Gestalt und Funktionsfähigkeit ihrer Finger. Wie die korrekte Entwicklung der Hand und das Wachstum der einzelnen Finger gesteuert werden, war bislang jedoch unbekannt.
Finger-Fehlbildung als Ausgangspunkt
Wissenschaftler vom Berliner Max-Planck-Institut für molekulare Genetik in Berlin haben jetzt gemeinsam mit mit Kollegen vom Institut für Medizinische Genetik der Charité – Universitätsmedizin Berlin und weiteren Partnern herausgefunden, wie das Längenwachstum der Finger durch ein fein abgestimmtes Netzwerk von unterschiedlichen Signalwegen gesteuert wird. Um normale Entwicklungsprozesse im menschlichen Körper zu verstehen, untersuchen Wissenschaftler häufig Krankheiten, bei denen genau diese Prozesse gestört sind.
„Bisher weiß niemand, wie bei Säugetieren, also auch beim Menschen, die Finger genau entstehen und wie ihr Wachstum gesteuert wird“, erklärt Sigmar Stricker, Wissenschaftler am Max-Planck-Institut für molekulare Genetik. Ausgangspunkt für die neue Studie waren daher eine Reihe von Erkrankungen, die alle mit einer Verkürzung der einzelnen Fingerglieder einhergehen. Diese so genannten Brachydaktylien können durch Mutationen an verschiedenen Genen verursacht werden.
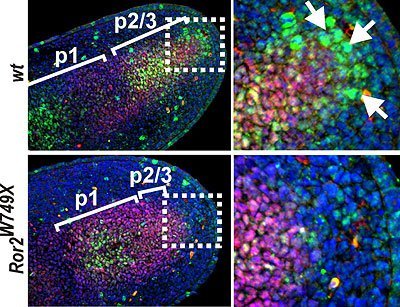
Aktivität knochenmorphogenetischer Proteine entscheidend
Die Forscher untersuchten zwei Gruppen von Mäusen, bei denen jeweils ein Gen so verändert war, dass es der Mutation bei den menschlichen Brachydaktylien A1 bzw. B1 entsprach. Die Wissenschaftler stellten fest, dass bei beiden Mäusegruppen die Aktivität des Signalwegs für „Knochenmorphogenetische Proteine“ (bone morphogenetic proteins, BMP) betroffen war. BMPs sind eine Gruppe von Signalproteinen, die von einigen Zellen eines Organismus ausgeschüttet werden, um direkt benachbarte Zellen zu beeinflussen. Sie fungieren vor allem als Wachstumsfaktoren, dies ist jedoch nicht ihre einzige Funktion.
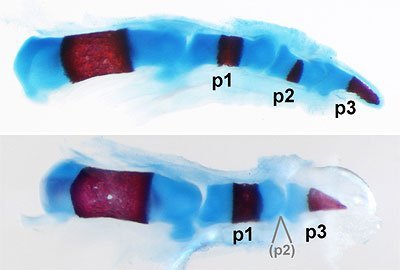
Signalzentrum vor jedem neuen Fingerglied
„Bei allen Tieren fanden wir ein Signalzentrum direkt vor dem sich neu bildenden Skelettelement beziehungsweise Fingerglied, welches eine besonders hohe Aktivität des BMP-Signalweges aufwies,“ so Stricker. „Dieses Signalzentrum ist dafür verantwortlich, unspezifische embryonale Bindegewebszellen (Mesenchymzellen) zur Umwandlung in Knorpelzellen anzuregen. Die Knorpelzellen entwickeln sich im nächsten Schritt zu Knochenzellen, das bedeutet, der Finger wächst in die Länge.“
Durch genetische und molekulare Experimente konnten die Wissenschaftler zeigen, dass das Signalzentrum durch eine Reihe weiterer Signalmechanismen (IHH, ROR2, WNT) gesteuert wird. Ihre Arbeit beschreibt zum ersten Mal den genetischen und molekularen Mechanismus des Fingerwachstums bei Säugetieren und beleuchtet dessen Rolle bei der Entstehung von menschlichen
Brachydaktylien.
(Max-Planck-Institut für molekulare Genetik, 27.07.2010 – NPO)