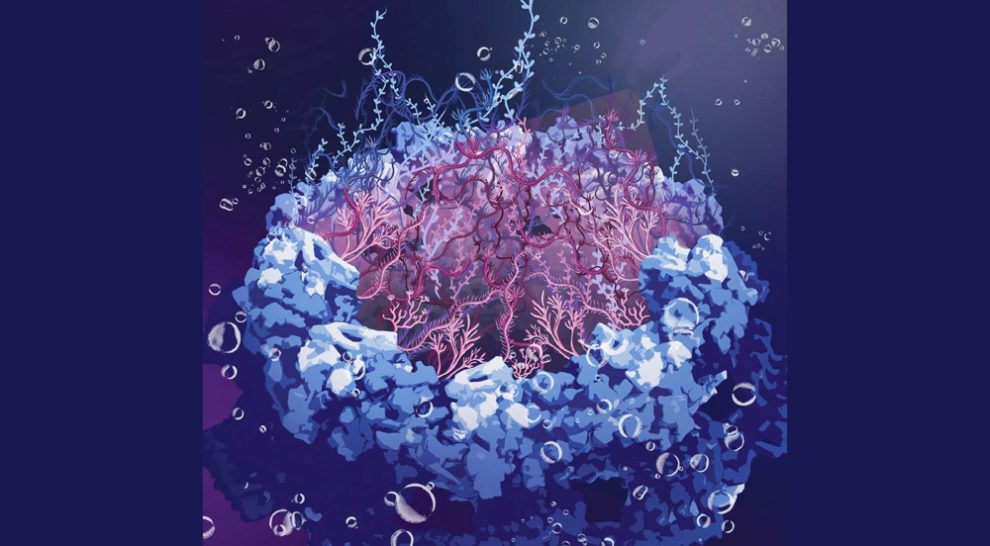
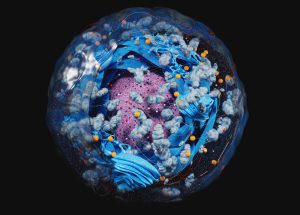
Schutz für unsere DNA: Forschende haben erstmals die Struktur der Kernporen in unseren Zellkernen entschlüsselt – der Öffnungen, die für die Funktion und den Schutz unserer DNA entscheidend sind. Demnach wird der Zugang zum Zellkern von einem beweglichen Kranz aus Proteinfäden geschützt. Diese spaghettiähnlich ungeordneten Fäden lassen nur entsprechend „etikettierte“ Moleküle durch, wehren aber Viren und Schadstoffe ab, wie das Team in „Nature“ berichtet.
Unser genetisches Erbmaterial ist im Zellkern verstaut und durch die Kernmembran vom Rest der Zelle getrennt. Damit Botenstoffe, RNA und Stoffwechselprodukte dennoch in den Kern hinein- oder hinauskommen, sind rund 2.000 Poren in die Kernmembran eingebaut, die aus jeweils etwa 1.000 Proteinen bestehen. Die Kernporen agieren als molekulare Türsteher: Sie lassen für die Zellfunktion wichtige Moleküle durch und sperren Krankheitserreger oder Giftstoffe aus. Das Pensum dieser molekularen Wächter ist dabei enorm: Sie müssen im Schnitt mehrere zehntausend „Besucher“ pro Minute kontrollieren.
Poren mit Fangarmen
Doch wie schaffen die Kernporen diese Mammutaufgabe? Diese Frage beschäftigt Wissenschaftler schon seit Jahrzehnten. Es gab bereits erste Hinweise darauf, dass am Gerüst der Kernpore zahlreiche Proteine befestigt sind, die wie Fangarme tief in die zentrale Öffnung hineinragen. „Diese FG-Nucleoporine (FG-NUP) bilden eine permeable Barriere im Zentralkanal der Kernpore, die die Passage großer Frachten blockiert, sofern diese nicht eine bestimmte Erkennungssequenz präsentieren“, erklären Miao Yu von der Universität Mainz und ihre Kollegen.
Wie diese Protein-Tentakel aber angeordnet sind und wie sie Eindringlinge abblocken, blieb unklar. Denn diese Porenproteine bestehen aus ungeordneten Sequenzen ohne feste dreidimensionale Faltung und Struktur. Sie bewegen sich ständig und verändern flexibel ihre Form – wie Spaghetti im kochenden Wasser. Genau darin liegt das Problem: Die meisten Techniken zur Analyse und Abbildung von Proteinen funktionieren nur mit einer stabilen, geordneten 3D-Struktur, die die intrinsisch ungeordneten Kernporen-Proteine (IDP) aber nicht haben.