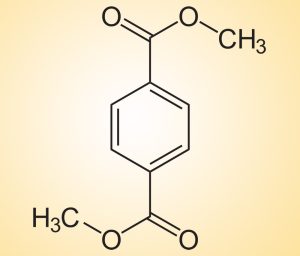
Warum entladen sich Lithium-Ionen-Akkus mit der Zeit – selbst wenn sie nicht in Gebrauch sind? Dahinter steckt ein verblüffend simpler Grund, wie nun Forscher entdeckt haben: Die aufgerollten Elektroden dieser Batterien werden mit einfachem PET-Klebeband zusammengehalten. Wenn der Akku jedoch warm wird, wird dieser Allerweltskunststoff zu Dimethyl-Terephthalat (DMT) zersetzt – und dieses Molekül wirkt wie ein elektrochemisches Shuttle, das die Batterie entlädt.
Lithium-Ionen-Akkus sind die wichtigsten Stromlieferanten für mobile Technik – vom Handy über den Laptop bis zum Elektroauto. Ihre hohe Energiedichte, das vergleichsweise geringe Gewicht und die lange Haltbarkeit machen diese Batterien nahezu unverzichtbar. Allerdings sind auch sie nicht perfekt: Nach längerem Gebrauch führen Lithiumablagerungen zu einem schleichenden Leistungsverlust und wenn sie zu heiß werden, können Lithium-Akkus sogar explodieren.
Was ist der Grund für die Selbstentladung?
Und noch ein Problem gibt es, das fast jeder schon im Alltag erlebt hat: Selbst wenn Lithium-Ionen-Akkus gar nicht in Gebrauch sind, verlieren sie mit der Zeit ihre Ladung. Schon länger vermuten Wissenschaftler, dass ein sogenanntes Redox-Shuttle an dieser Selbstentladung schuld ist. Dabei handelt es sich um ein elektrochemisch aktives Molekül, das an der Kathode des Akkus reduziert wird und dabei ein Elektron aufnimmt. Dann wandert es zur Anode und wird dort durch unter Elektronenabgabe wieder oxidiert.
„Für jedes Elektron, das auf diese Weise von der negativen zur positiven Elektrode transportiert wird, bewegt sich auch ein Lithium-Ion dorthin und verursacht so die Selbstentladung“, erklären Sebastian Buechele von der Dalhousie University im kanadischen Halifax und seine Kollegen. Doch welches Molekül steckt dahinter? Und woher kommt das molekulare Shuttle in den Lithium-Ionen-Akkus?