Die Zellteilung ist die Grundlage allen Lebens vom Einzeller bis zum komplexen Organismus. Nur dadurch kann ein Lebewesen wachsen und sich regenerieren. Gerät dieser Mechanismus außer Kontrolle, können Krankheiten wie Krebs auftreten. Nun hat ein internationales Wissenschaftlerteam neue Erkenntnisse über die Krebsentstehung und die Regulation des Zellzyklus gewonnen und dabei zwei alte Rätsel bei der Zellteilung gelöst. Die Forscher berichten über ihre Ergebnisse in der aktuellen Ausgabe der Fachzeitschrift Cell.
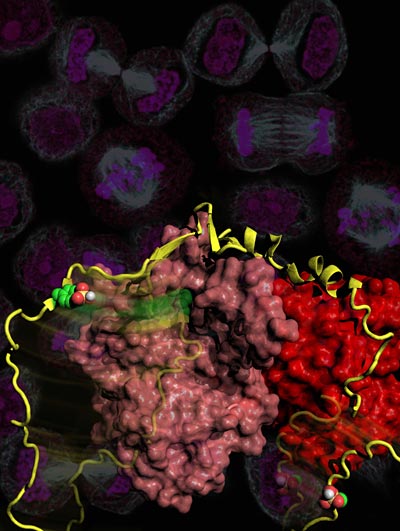
Proteinkinasen aus der Familie der Cyclin-abhängigen Kinasen (CDK) sind der zentrale Motor, der Zellen durch die Zellteilung treibt. Als Bremse für diesen Motor dienen so genannte CDK-Inhibitoren, die an CDKs binden und sie dadurch inaktivieren können. Eines dieser CDK-inhibierende Proteine, p27Kip1, wurde von Professor Ludger Hengst vom Biozentrum der Medizinischen Universität Innsbruck vor einigen Jahren entdeckt. Nun hat seine Arbeitsgruppe einen Mechanismus entdeckt, über den bestimmte krebsauslösende Proteine (Onkogen-Produkte) diese Bremsen ausschalten können und damit Zellen zu unkontrollierten Teilungen antreiben.
Zwei Rätsel der Zellteilung gelöst
Die Forscher um Hengst hat zusammen mit amerikanischen Forschern in Memphis und Miami nachgewiesen, dass die Aktivität und die Stabilität dieses CDK-inhibierenden Proteins von so genannten krebsauslösenden – onkogenen – Tyrosinkinasen reguliert wird. Diese phosphorylieren den CDK-Inhibitor p27Kip1 und verändern damit dessen Funktion. Dadurch kann er CDKs binden, ohne sie aber vollständig zu inaktivieren. Bestimmte CDK Komplexe könnten sogar durch den Inhibitor zusammengebaut und so aktiviert werden. Mit ihrer Arbeit haben die Wissenschaftler ein Rätsel gelöst, das die Zellforscher seit Jahren beschäftigt hat.
Schon lange gab es Hinweise, dass bestimmte CDK-Inhibitoren auch aktivierende Funktionen im Zellzyklus übernehmen können. Die neuen Ergebnisse bestätigen nun, dass diese Proteine eine durchaus widersprüchliche Natur haben. Sie erklären auch, wodurch die Funktionsänderung zustande kommt und wie sie in normalen und in Tumorzellen ausgelöst wird. Die Forscher konnten noch ein weiteres Rätsel der Zellteilung aufklären, denn die Tyrosinkinasen lösen auch den Abbau der CDK aus.