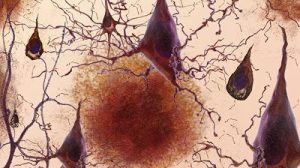
Das Muster verrät’s: Das Muster eines trocknenden Probentröpfchens könnte künftig verraten, ob jemand Alzheimer im Frühstadium hat. Sind in der Probe fehlgefaltete Amyloid-Beta-Proteine enthalten, verändert dies das Trocknungsmuster der Lösung auf charakteristische Weise, wie Forschende entdeckt haben. In ersten Tests erkannte ein darauf trainierter Algorithmus diesen „Fingerabdruck“ mit 99-prozentiger Treffsicherheit – und dies, ohne dass aufwändige Aufbereitungs- und Analysemethoden nötig waren.
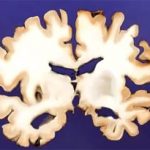
Alzheimer ist die häufigste neurodegenerative Erkrankung im Alter. Bis jedoch eine Diagnose gestellt werden kann, ist der Abbau der Gehirnzellen oft schon weit fortgeschritten. Denn objektive, leicht zu testende Biomarker für eine Früherkennung fehlen bisher. Zwar lassen sich Frühzeichen der Demenz an den Hirnströmen, der Darmflora oder auch Bluttests erkennen. Diese Methoden sind jedoch noch im Teststadium und erfordern oft aufwendige Verfahren und Geräte.
Trocknungsflecken als Indikatoren?
Möglicherweise geht es aber auch einfacher: Azam Jeihanipour und Jörg Lahann vom Karlsruher Institut für Technologie (KIT) haben eine Methode entwickelt, die die Präsenz krankhaft veränderter Amyloid-Beta-Proteine in Blut- oder Liquorproben auf einfache Weise anzeigen könnte. Solche fehlgefalteten Beta-Amyloide gelten als Indikatoren für Alzheimer. Sie können im Gehirn nicht richtig abgebaut werden und bilden daher Verklumpungen, die die Neuronen schädigen und absterben lassen.
Basis der neuen Methode bilden die sognannten „Kaffeering“-Flecken – die Flecken, die eine eingetrocknete Lösung auf einer Unterlage hinterlässt. Die Struktur solcher Trockenflecken wird stark von den chemischen Merkmalen der Inhaltsstoffe beeinflusst – und damit auch von der dreidimensionalen Faltung und Struktur der Proteine. „Publizierte Fleckenmuster von Peptid- und Proteinlösungen reichen von homogenen Filmen über verästelte und gitterförmige Muster bis zu komplexeren Arrangements“, erklären Jeihanipour und Lahann.
Amyloid-Tröpfchen im Test
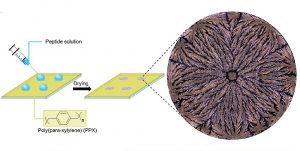
Um herauszufinden, ob sich auch gesunde und krankhafte Beta-Amyloid-Varianten anhand dieses Trockungsmusters unterscheiden lassen, lösten die Forschenden verschiedene Amyloid-Varianten in einer Bikarbonat-Pufferlösung und gaben jeweils zwei Mikroliter davon als Tropfen auf eine zuvor speziell beschichtete Glasfläche. Die Tropfen wurden dann 40 Minuten unter kontrollierten Bedingungen getrocknet.
Das Ergebnis sind rund zwei Millimeter große Trockenflecken, die unter dem Polarisationsmikroskop ein charakteristisches Muster aufweisen. Im Zentrum der Flecken haben sich vorwiegend Salzkristalle der Pufferlösung abgelagert, am Außenrand bilden Peptide und Salzkristalle einen relativ homogenen Rand. In der mittleren Zone jedoch sind verästelte Strukturen zu erkennen, die sich von innen nach außen ziehen und für jede Peptidvariante spezifisch zu sein schienen.
„Die Unterschiede zwischen diesen Mustern mit bloßem Auge zu erkennen, ist allerdings eine ziemliche Herausforderung, weil sie sich sehr ähnlich sehen“, erklären die Forschenden. Sie haben daher die Hilfe eines lernfähigen Algorithmus in Anspruch genommen. Dieses Deep-Learning-System wurde zunächst mit rund 400 Fleckenmuster-Aufnahmen pro Amyloid-Variante trainiert. Dann sollte der Algorithmus 720 neue Bilder der acht Peptid-Konfigurationen selbstständig klassifizieren.
99 Prozent Treffsicherheit
Und tatsächlich: Das KI-System konnte die Struktur und Faltung der Beta-Amyloid-Ketten allein anhand der Trockenflecken erkennen und richtig zuordnen. „Die Fleckenmuster waren nicht nur charakteristisch und reproduzierbar, sondern führten auch zu einer Klassifizierung mit einer Vorhersagegenauigkeit von über 99 Prozent“, berichtet Lahann. „Da die Strukturen sehr ähnlich und mit dem bloßen Auge nur schwer zu unterscheiden sind, war es durchaus überraschend, dass die neuronalen Netzwerke so effektiv waren.“
Nach Ansicht der Forschenden demonstriert dies, dass sich die verschiedenen für Alzheimer relevanten Amyloid-Varianten auch mit dieser vergleichsweise simplen und schnellen Methode erkennen lassen. „Die Fleckenmuster von Amyloid-beta-Peptiden repräsentieren Fingerabdrücke, die die strukturelle und räumliche Identität des Peptides widerspiegeln“, sagt Lahann.
Damit habe diese Methode großes Potenzial, als schneller und einfacher Test zur Früherkennung von Alzheimer und auch Parkinson eingesetzt zu werden. (Advanced Materials, 2022; doi: 10.1002/adma.202110404)
Quelle: Karlsruher Institut für Technologie