Neuronale Entsorgung: Wenn die Drainage des Gehirns nicht richtig funktioniert, behindert dies auch die Alzheimer-Therapie, wie nun Versuche mit Mäusen nahelegen. Demnach ist ein intakter Abfluss wichtig, damit schädliche Protein-Ablagerungen abtransportiert werden. Die Kombination von Alzheimer-Mitteln mit Wirkstoffen, die die zerebrale Lymphdrainage fördern, könnte die Demenz daher effektiver bremsen, wie die Forscher im Fachmagazin „Nature“ berichten.
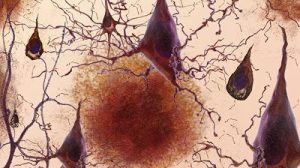
Bei der neurodegenerativen Krankheit Alzheimer lagern sich im Gehirn Plaques aus fehlgefalteten Amyloid-Beta-Proteinen ab. Diese beeinträchtigen den Hirnstoffwechsel und tragen zum Absterben von Neuronen bei. Viele Therapien zielen daher darauf, diese Plaques aufzulösen. Bisherige Studien zu Antikörper-Therapien gegen Plaques lieferten jedoch gemischte und häufig enttäuschende Ergebnisse.
Verstopfter Abfluss erschwert Behandlung
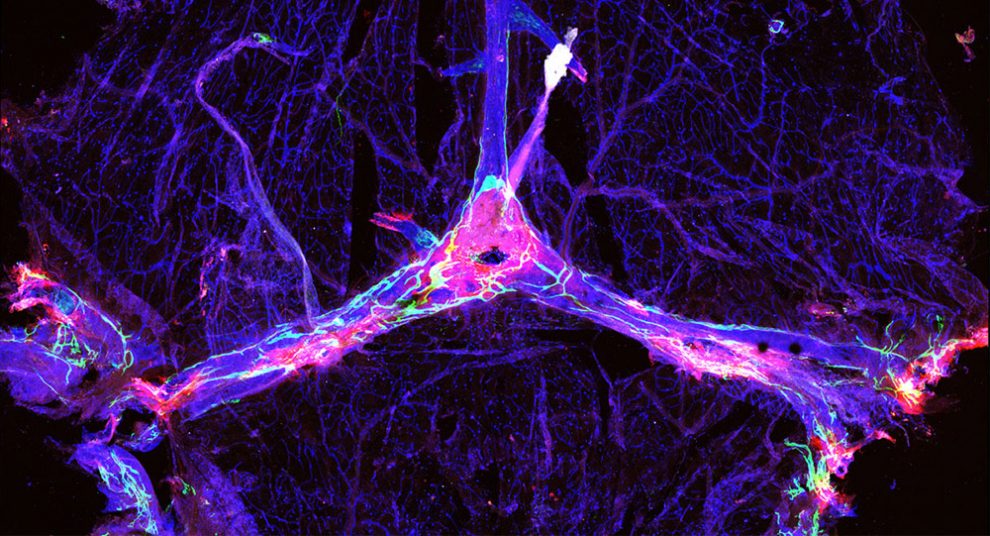
Ein Team um Sandro Da Mesquita von der University of Virginia hat nun eine mögliche Erklärung für die unzuverlässige Wirkung bisheriger Therapien gefunden: Wie die Forscher an Mäusen gezeigt haben, spielt das Drainagesystem des Gehirns, die sogenannten meningealen Lymphgefäße, eine entscheidende Rolle für den Verlauf der Krankheit und die Wirksamkeit von Behandlungen.
„Die Lymphgefäße sind wie ein Abfluss“, erklärt Da Mesquitas Kollege Jonathan Kipnis. „Alzheimer und andere neurodegenerative Erkrankungen wie Parkinson und frontotemporale Demenz sind durch eine Proteinaggregation im Gehirn gekennzeichnet. Wenn man diese Aggregate aufbricht, aber keine Möglichkeit hat, die Trümmer loszuwerden, weil der Abfluss verstopft ist, hat man nicht viel erreicht. Man muss den Abfluss frei machen, um das Problem wirklich zu lösen.“
Kipnis zufolge könnten die widersprüchlichen Ergebnisse bisheriger Medikamentenstudien durch Unterschiede im Lymphsystem der untersuchten Patienten zu erklären sein. Während Personen mit weitgehend intakter Abfallbeseitigung von den Therapien profitieren konnten, waren sie bei Patienten mit verstopften Drainagen wirkungslos.
Vergleich von Mäusen und Menschen
Um diese These zu prüfen, nutzten die Forscher Mäuse, die durch genetische Modifikationen besonders anfällig für Amyloid-Ablagerungen im Gehirn sind. Bei einem Teil dieser Tiere beschädigten die Forscher gezielt die meningealen Lymphgefäße. Dann untersuchten sie bei allen Mäusen die Mikroglia, eine bestimmte Art von Immunzellen im Gehirn, die an der Alzheimer-Krankheit beteiligt sind.
Das Ergebnis: Bei Mäusen mit beschädigtem Lymphsystem waren die Mikroglia in einem Zustand, der die Neurodegeneration eher begünstigt. Beim Menschen lassen sich vergleichbare Schäden im meningealen Lymphsystem allerdings nicht direkt nachweisen. Um dennoch darauf schließen zu können, ob solche Schäden auch bei Menschen eine Rolle spielen, verglichen die Forscher die Genexpression der Mikroglia im Gehirn verstorbener Alzheimer-Patienten mit der der Mäuse.
Und tatsächlich: „Es gab eine Signatur, die wir in den Mikroglia von Mäusen mit beschädigten meningealen Lymphgefäßen fanden“, berichtet Koautor Oscar Harari von der Washington University in St. Louis. „Als wir die Mikroglia-Daten von Menschen und Mäusen verglichen, fanden wir die gleiche Signatur in den menschlichen Daten.“ Das deute darauf hin, dass die Ergebnisse auf Menschen übertragbar seien.
Implikationen für zukünftige Therapien
Im nächsten Schritt testeten die Forscher, inwieweit ihre Erkenntnisse auch Implikationen für die Alzheimer-Therapie haben könnten. Dazu behandelten sie die Mäuse, deren Lymphgefäße beschädigt waren, mit Aducanumab, einem Antikörper gegen Amyloid-Plaques, der sich bereits in manchen klinischen Studien als erfolgreich erwiesen hat. Ein Teil der Tiere erhielt zusätzlich einen Wirkstoff, der das Wachstum von Lymphgefäßen fördert.
Tatsächlich reduzierte die Kombinationstherapie die Amyloid-Ablagerungen stärker als die Anti-Amyloid-Medikamente allein. „Diese Ergebnisse deuten darauf hin, dass die Unterstützung des meningealen Lymphsystems bei Menschen mit Alzheimer zu besseren Behandlungsergebnissen führen könnte“, sagt Molly Wagster vom US National Institute on Aging. Sollten sich die Ergebnisse in weiteren Studien bestätigen, könnten sie ein wichtiger Schritt auf dem Weg zu besseren Alzheimer-Therapien sein. (Nature, 2021; doi: 10.1038/s41586-021-03489-0)
Quelle: Washington University School of Medicine, NIH/National Institute on Aging