Optimierte Konfiguration: Forscher haben herausgefunden, warum die Deltavariante von SARS-CoV-2 infektiöser ist als ihre Vorgänger. Demnach verändern ihre Mutationen die Konfiguration des Spike-Proteins so, dass dieses Coronavirus schneller als andere Varianten an Zellen andocken und in sie eindringen kann. Ein weiterer Unterschied: Die Deltavariante ist bei Zellen mit weniger ACE2-Rezeptoren im Vorteil und kann auch deshalb effektiver angreifen.
Das Coronavirus passt sich immer weiter an seine Wirte an – an unsere Zellen. Davon zeugt auch die Deltavariante, die inzwischen bei uns und fast überall zur dominanten Form von SARS-CoV-2 geworden ist. Schon früh war klar, dass diese mutierte Form des Virus ansteckender ist als frühere Formen und auch Geimpfte häufiger infizieren kann. Einigen Indizien zufolge könnte die Deltavariante auch krankmachender sein, dies ist bislang aber noch strittig.
Warum ist die Übertragung so schnell und effektiv?
Doch warum ist die Deltavariante so viel ansteckender als ihre Vorgänger? Selbst ein kurzer Kontakt reicht oft schon aus, um sich zu infizieren, zudem ist die Inkubationszeit kürzer und die Viruslast kurz nach der Infektion um bis zu tausendmal höher. Welche viralen und zellulären Merkmale dahinterstecken, haben nun Jun Zhang von der Harvard Medical School in Boston und seine Kollegen genauer untersucht.
„Wir dachten uns, dass das anders laufen muss als bei den anderen Varianten, weil Delta so aus ihnen herausragt“, erklärt Zhangs Kollege Bing Chen. Für ihre Studie setzten sie menschliche Zellkulturen den viralen Spike-Proteinen verschiedener Coronaviren-Varianten aus, darunter Alpha, Delta sowie die ebenfalls in Indien entstandene Kappavariante. Die Zellen trugen je nach Ansatz eine unterschiedlich hohe Dichte von ACE2-Rezeptoren auf ihrer Oberfläche – sie sind die primären Andockstellen für das Virus.
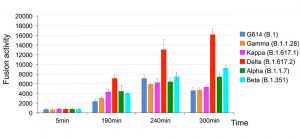
Zwei optimierte Faktoren identifiziert
Die Experimente enthüllten: Die Deltavariante befiel die Zellen deutlich schneller und effektiver als die restlichen Varianten. Dies lag zum einen an ihrer verbesserten Fähigkeit zur Verschmelzung mit der Zellmembran – dem entscheidenden Schritt zum Eindringen in die Zelle: „Die Membranfusion erfordert viel Energie und einen Katalysator“, erklärt Chen. „Die Deltavariante erzielte diese Katalyse besser als alle anderen.“ Ihre Verschmelzungsraten lagen vor allem zu Beginn der Explosion fasst doppelt so hoch wie bei Alpha und Co.
Dazu kommt noch ein zweiter Vorteil: Wurden in den Experimenten Zellkulturen mit hohen Dichten an ACE2 verwendet, glichen sich die Befallsraten mit der Zeit nahezu an. Anders jedoch, wenn die Zielzellen nur wenig ACE2-Andockstellen auf ihrer Oberfläche trugen: Dann konnte die Deltavariante die Zellen weit effektiver infizieren als die anderen Virentypen. „Dies spricht dafür, dass Delta sich daran angepasst hat, die Membranfusion auch bei Zellen mit niedriger Rezeptordichte zu optimieren“, erklärt das Team.
Nach Ansicht der Wissenschaftler sind es vor allem diese beiden Anpassungen, die die Deltavariante so infektiös machen: „Diese Optimierung kann erklären, warum die Deltavariante schon bei relativ kurzem Kontakt übertragen werden kann“, schreiben Zhang und seine Kollegen. Denn selbst wenn die ACE2-Dichte in Rachen und Nase gering ist, fasst der Erreger dort Fuß. „Weil das Virus mehr Zellen in kürzerer Zeit infizieren kann, führt dies zu einer kürzeren Inkubationszeit und einer höheren Virenlast nach der Infektion“, so die Forscher weiter.
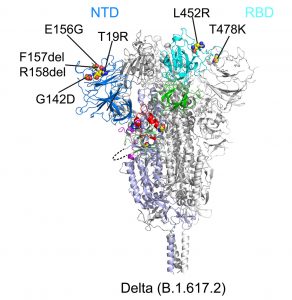
Welche Mutationen sind dafür verantwortlich?
Verantwortlich für die Optimierung der Deltavariante sind aber offenbar nicht die Mutationen an der Bindungsstelle des Spike-Proteins, wie ergänzende Analysen mittels Cryo-Elektronenmikroskopie ergaben. An der Bindungsstelle ist die Deltavariante nur an zwei Stellen gegenüber ihren Vorgängern verändert. „Diese Veränderungen liegen nicht an der Oberfläche, die mit ACE2 in Kontakt kommt und haben wenig Einfluss auf die Rezeptorbindung“, konstatieren Zhang und sein Team.
Deutlichere Veränderungen gibt es dagegen in der Konfiguration der N-Terminalen Domäne (NTD). Dieser Teil des Spike-Proteins ist für die Faltung des Virus beim Andocken an die Zellen wichtig. Erst durch dieses Umklappen der Proteinkonfiguration kann die Verschmelzung mit der Zellmembran stattfinden und das Virus in die Zelle eindringen. Wie die Analysen enthüllten, weist die N-Terminale Domäne von Delta drei Punktmutationen und zwei fehlende Aminosäuren auf, die die Form mehrerer Proteinschleifen verändern. Das könnte erklären, warum die Deltavariante besser mit unseren Zellen verschmelzen kann.
Immerhin hat all dies auch ein Positives: Weil sich die Bindungsstelle des Coronavirus auch bei der Deltavariante kaum verändert hat, sind die meisten Antikörper und Impfstoffe weiterhin wirksam. Auch für die Zukunft könnte dies gelten: „Wir sollten nicht auf die N-Terminale Domäne zielen, weil das Virus hier schnell mutieren und seine Struktur ändern kann“, erklärt Chen. Viel effektiver sei es, mit Schutz- und Gegenmaßnahmen an der weniger variablen Bindungsstelle anzusetzen. (Science, 2021; doi: 10.1126/science.abl9463)
Quelle: Boston Children’s Hospital