Helfer im Nebenjob: Unsere Zellen schützen sich mit einer raffinierten Doppelstrategie gegen oxidativen Stress: Fällt die normale Schutztruppe der Chaperon-Proteine wegen allzu aggressiver Sauerstoff-Radikale aus, wird eine zweite Rettungstruppe aktiv und bewahrt die zelleigenen Proteine vor schädlichen Folgen, wie Forscher nun herausgefunden haben.
Mit Sauerstoff verbinden die meisten Menschen vor allem Positives: Jede einzelne Zelle des Körpers benötigt ihn. Tritt Sauerstoff jedoch in Form von reaktiven Radikalen auf, ist er extrem schädlich für den Körper. Diese aggressiven Sauerstoff-Verbindungen entstehen, wenn UV-Licht auf die Zellen trifft oder durch chemische Substanzen, die zum Beispiel in Zigarettenrauch enthalten sind. Man spricht dann von oxidativem Stress. Er greift das Erbgut an oder verändert die Faltung der Proteine so, dass sie ihre Aufgaben nicht mehr ausführen können.
Normalerweise ist eine Zelle gegen solche Angriffe gewappnet: Droht ein Protein aus der Form zu geraten, eilen „Rettungs-Proteine“, sogenannte Chaperone, hinzu. Sie halten das hilfsbedürftige Protein so fest, dass es seine Faltung nicht verlieren kann. Aber: Dieser zelluläre Rettungsdienst versagt, wenn radikaler Sauerstoff im Spiel ist. Denn die Radikale rauben den Zellen auch ihre wichtigsten Energieträger, die ATP-Moleküle. Ohne ATP fehlt den Chaperonen jedoch der Treibstoff für ihre Arbeit – sie können die beschädigten Proteine nicht mehr am Entfalten hindern.
Rettungshelfer im Nebenjob
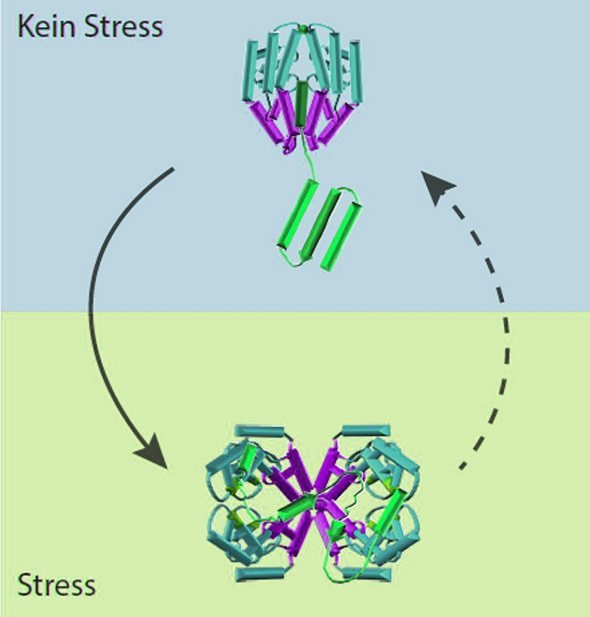
Doch wie Blanche Schwappach von der Universitätsmedizin Göttingen und ihre Kollegen nun herausfanden, haben die Zellen trotzdem einen Notfallplan. Wie sie feststellten springt ein Protein namens Get3 ein, wenn die eigentlichen Rettungskräfte durch den radikalen Sauerstoff außer Gefecht gesetzt sind. Get3 hat normalerweise eine andere Aufgabe in der Zelle. Wird es jedoch von reaktivem Sauerstoff angegriffen, verwandelt es sich selbst in einen Protein-Retter und lässt dafür seine ursprüngliche Aufgabe liegen.
Auf die Spur von Get3 kamen die Wissenschaftler, als sie Hefezellen untersuchten, denen dieses Protein fehlt. „Zellen ohne Get3 haben einen bemerkenswerten Defekt“, sagt Schwappach. Diese Zellen reagieren besonders empfindlich auf oxidativen Stress.“ Normalerweise ist Get3 dafür zuständig, bestimmte Proteine in Membranen der Zelle zu verankern. Diese Funktion hat nichts mit oxidativem Stress zu tun. Bei ihren Arbeiten stellten die Forscher jedoch fest, dass Get3 seine Faltung grundlegend ändert, wenn es Sauerstoff ausgesetzt ist. In diesem Zustand konnte Get3 auch andere Proteine davor retten, ihre Faltung zu verlieren – es arbeitete also als Chaperon.
Erste Hilfe ohne ATP
Mehr noch: Anders als der zelluläre Rettungsdienst leistet Get3 seine Erste Hilfe ohne ATP. Es kann also auch bei oxidativem Stress anderen Proteinen beistehen. Dafür arbeitet es im Team: Vier oder mehr Get3-Chaperone tun sich zusammen und kümmern sich um ein beschädigtes Protein. „Entscheidend ist, dass Get3 zwischen seinen beiden Faltungen und Funktionen hin- und herwechseln kann“, sagt Wilhelm Voth, der an der Universitätsmedizin Göttingen und der University of Michigan forscht. „Seine Veränderung durch radikalen Sauerstoff ist also umkehrbar.“
Die Proteinforscher haben damit entdeckt, dass Get3 zu einer besonders faszinierenden Gruppe von Proteinen gehört: Diese haben im Laufe der Evolution neben ihrer eigentlichen Funktion eine zweite Aufgabe übernommen, die von der ersten oft völlig verschieden ist. Je nach Bedarf können sie die eine oder andere Tätigkeit übernehmen. „Als Rettungsassistent arbeitet es sozusagen nur im Nebenjob“, sagt Schwappach. (Molecular Cel, 2014; doi: 10.1016/j.molcel.2014.08.017)
(Universitätsmedizin Göttingen – Georg-August-Universität, 01.12.2014 – NPO)