Ohne Eizelle und Gebärmutter: Zwei Forschungsteams ist es erstmals gelungen, Mäuseembryos im „Reagenzglas“ zu züchten – aus einzelnen Stammzellen statt befruchteten Eizellen. Die Stammzellkulturen bildeten einen Dottersack, Vorstufen der Plazenta und den Embryo. Dieser entwickelte sich weiter, bis er schlagende Herzzellen und die Vorstufen aller Organe inklusive Darm und Gehirn aufwies. Zum ersten Mal wurden damit die entscheidenden Schritte der Embryonalentwicklung ohne befruchtete Eizellen und außerhalb des Mutterleibs vollzogen.
Die Entstehung neuen Lebens aus nur einer befruchteten Zelle ist ein Wunder der Natur – und ein ungeheuer komplexer Prozess. Unzählige genetische, chemische und mechanische Signale sorgen dafür, dass die im Laufe der frühen Embryonalentwicklung gebildeten Zellen an die richtige Stelle wandern und sich zum dort benötigten Gewebetyp ausdifferenzieren.
Komplexe Abläufe
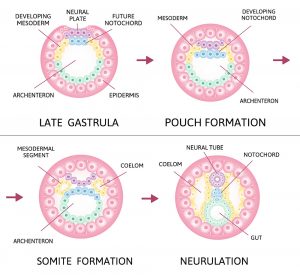
Doch damit sich der Embryo entwickeln und einnisten kann, müssen aus der befruchteten Eizelle neben den Zellen des Embryos auch der Dottersack gebildet werden, der den Embryo in den ersten Tagen ernährt, und die Plazenta, die später zusammen mit mütterlichem Gewebe die Versorgung übernimmt. Die Differenzierung in diese drei Hauptzelltypen – einen embryonale und zwei extraembryonale – geschieht im Stadium der Blastozyste, wenige Tage nach der Befruchtung.
Auf dieses Stadium folgt die Gastrulation des Embryos mit der Bildung der Keimblätter und im weiteren Verlauf die Bildung der ersten Organvorstufen inklusive des Neuralrohrs, aus dem das Gehirn und Rückenmark entstehen. „Diese Periode bildet die Grundlage für alles andere, das in der Schwangerschaft folgt – geht hier etwas schief, scheitert die Schwangerschaft“, erklärt Seniorautorin Magdalena Zernicka-Goetz von der University of Cambridge und dem California Institute of Technology.
Stammzellen statt befruchteter Eizelle
Umso wichtiger ist es für die Medizin, diese frühe Embryonalentwicklung erforschen zu können – beispielsweise indem dieser Prozess im Labor nachvollzogen wird. Die steuernden Mechanismen lassen sich am besten identifizieren, wenn man nicht einfach der befruchteten Eizelle beim Entwickeln zusieht, sondern versucht, die Abläufe mit einem synthetischen Embryo zu rekonstruieren. Dieser entsteht nicht durch Befruchtung, sondern beginnt seine Entwicklung ausgehend von einzelnen Stammzellen.
Die Züchtung eines solchen künstlichen Embryos aus Stammzellen ist nun erstmals zwei Forschungsteams im Labor gelungen. Ausgangspunkt waren dabei jeweils drei verschiedene Arten von Mäusestammzellen, die in eigens dafür entwickelten, rotierenden Kulturgefäßen zusammengebracht wurden. Durch Anschalten bestimmter Gene und speziell angepasste Nährmedien imitierten die Forschenden die natürlichen Einflüsse im Mutterleib und brachten die Zellen dazu, sich zu den beiden extraembryonalen Geweben und einem Embryo weiter zu entwickeln.
Embryo mit Dottersack und Plazenta
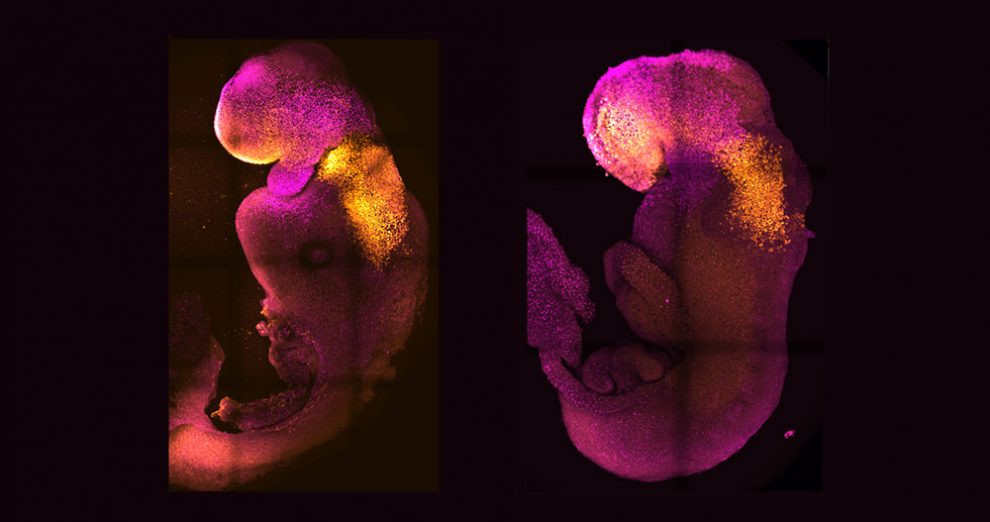
Mit Erfolg: Die anfangs ungeordneten Stammzellen durchliefen die gleichen Stadien wie natürliche Mäuseembryos: Sie bildeten eine Blastula, einen Dottersack und die Vorstufen einer Plazenta. Nach etwa fünf Tagen war die Körperachse sichtbar und die Gastrulation setzte ein. „Die Embryos ähnelten in dieser Phase einer natürlichen Gastrula, nur ihre Größen variierten ein wenig stärker“, berichtet das Team um Zernicka-Goetz.
Nähere Analysen enthüllten, dass die extraembryonischen Zellen in dieser frühen Phase wichtige Weichen stellen: Sie geben den embryonalen Zellen entscheidende chemische und mechanische Signale, die ihre weitere Entwicklung und Differenzierung prägen. „Diese Phase des menschlichen Lebens ist noch so geheimnisvoll, dass es geradezu fantastisch ist, dies nun zu beobachten“, sagt Zernicka-Goetz. „Wir sehen welche Dialoge zwischen den Stammzellen ablaufen müssen und was dabei schief gehen kann.“
Gehirn, Herz und Organvorstufen
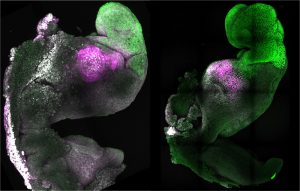
Noch wichtiger aber: Beiden Forschungsteams gelang es erstmals, den synthetischen Embryo bis zum Beginn der Organbildung weiterzuzüchten. „Unser Mausembryo-Modell entwickelte nicht nur ein Gehirn, sondern auch ein schlagendes Herz und alle weiteren Komponenten, die den Körper ausmachen“, berichtet Zernicka-Goetz. Am achten Tag – immerhin fast der Hälfte seiner gesamtne Entwicklungszeit – hatte der Embryo Anlagen für die Organe und Wirbelsäule, für den Verdauungstrakt und für alle Hirnteile. Sogar Vorläufer der Keimzellen entwickelten sich in der hinteren Region des Embryos.
„Es ist unglaublich, dass wir so weit gekommen sind“, sagt die Studienleiterin. Seit mehr als einem Jahrzehnt habe man versucht, diese Phasen der Embryonalentwicklung nachzubilden – jetzt sei es gelungen. Untersuchungen der Genaktivität und des Zellstoffwechsels zeigten, dass die aus Stammzellen gezüchteten Embryos darin mit ihren natürlichen Vorbildern weitgehend übereinstimmten. Nur bei einigen extraembryonalen Zelltypen gab es kleinere Unterschiede.
„Trotz dieser Unterschiede sind die gut acht Tage alten Embryos ihren natürlichen Gegenparts bemerkenswert ähnlich – egal ob diese im Uterus oder außerhalb herangewachsen sind“, berichtet das zweite Team unter Leitung von Jacob Hann vom Weizman Institute of Science in Israel.
„Enormes wissenschaftliches Potenzial“
Nach Ansicht der Forschenden eröffnen die durch diese Experimente erhaltenen Erkenntnisse wichtige Einblicke in die frühe Embryonalentwicklung und eröffnen nun neue Möglichkeiten, beispielsweise die Ursachen für Fehlbildungen zu erforschen. „Die Stammzell-Embryos sind wichtig, weil sie uns Zugang zu Entwicklungsstadien geben, die normalerweise im Mutterleib stattfinden“, sagt Zernicka-Goetz. „Die Modellembryos ermöglichen es uns nun, beispielsweise einzelne Gene zu manipulieren, um ihre Rolle in der Embryonalentwicklung zu verstehen.“
Auch nicht an den Studien beteiligte Forscher sehen in den Stammzelle-Embryos einen wichtigen Durchbruch. „Die beiden Arbeiten zu synthetischen Embryonen bergen ein enormes wissenschaftliches Potenzial. Am offensichtlichsten ist die Anwendung von synthetischen Embryonen als Alternativmethode zum Tierversuch an frühen Embryonen“, kommentiert der Humangenetiker Malte Spielmann vom Universitätsklinikum Schleswig-Holstein. Michele Boiani vom Max-Planck-Institut für molekulare Biomedizin in Münster sagt: „Diese Ergebnisse, die bei Mäusen erzielt wurden, sind atemberaubend.“
…aber auch ethische Fragen
Allerdings: Die bisher nur bei Mäuseembryos eingesetzte Methodik birgt auch ethischen Sprengstoff. Denn die beiden Forschungsteams arbeiten bereits daran, die Verfahren auch für menschliche Embryonen anzupassen. Dadurch könnte es möglich werden, menschliche Embryonen nur aus Stammzellen zu züchten – ohne Eizellen, Spermien oder Gebärmutter. Während Zernicka-Goetz und ihr Team darin eine Chance beispielsweise für die gezielte Zucht von Spenderorganen sehen, befürchten andere ethische Komplikationen:
„Wie weit könnte die (humane) Organogenese in einer Rollflasche im Vergleich zu einer Gebärmutter gehen? Das ist meine Hauptfrage und Sorge“, sagt Boiani. So könnten allein aus Stammzellen rekonstruierte synthetische Embryos das reproduktive Klonen von Menschen ermöglichen – für viele eine ethisch inakzeptable Horrorvorstellung. Auch genetische Manipulationen des Embryos und damit Eingriffe in die Keimbahn könnten so einfacher werden. Bis es so weit ist, müssten allerdings noch einige methodische Hürden genommen werden. (Nature, 2022; doi: 10.1038/s41586-022-05246-3; Cell, 2022 doi: 10.1016/j.cell.2022.07.028)
Quelle: University of Cambridge, California Institute of Technology, Science Media Center