Spezifisches Muster: Forschende haben erstmals einen objektiven Biomarker für chronische Schmerzen gefunden – sie konnten ihren Patienten die Schmerzen direkt am Gehirn ablesen. Demnach verrät die Aktivität des im Stirnhirn liegenden orbitofrontalen Cortex, ob ein Mensch chronische Schmerzen hat und wie stark sie sind, wie das Team in „Nature Neuroscience“ berichtet. Auch Unterschiede zur Reaktion auf akuten Schmerz zeigten die Messungen auf. Dies eröffnet Chancen einer gezielteren Diagnose und Therapie.
Ob Rückenschmerzen, Neuropathie oder der Phantomschmerz nach einer Amputation: Millionen Menschen weltweit leiden unter chronischen Schmerzen. Diese bleiben oft auch dann bestehen, wenn der ursprüngliche Auslöser kuriert ist. Grund dafür ist das Schmerzgedächtnis: Das anfängliche Bombardement mit Schmerzreizen hat anhaltende Veränderungen im Zellstoffwechsel, der Signalleitung und der Nervenaktivität in Rückenmark und Gehirn verursacht – der Schmerz hat sich dadurch verselbständigt.
„Schmerz ist eine der grundlegendsten Erfahrungen, die ein Organismus haben kann“, sagt Erstautor Prasad Shirvalkar von der University of California in San Francisco. „Trotzdem gibt es noch vieles, das wir über den Schmerz und seine Mechanismen nicht verstehen.“ Dies liegt auch am Fehlen einer objektiven Messmethode für chronische Schmerzen: Mediziner sind auf die Befragung und Selbsteinschätzung der Patienten angewiesen. Auch wo im Gehirn sich chronischer Schmerz manifestiert, ist erst in Ansätzen bekannt
Blick ins Schmerzgehirn
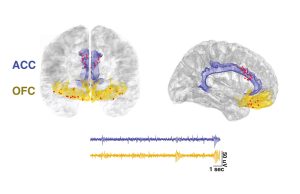
Um mehr herauszufinden, haben Shirvalkar und seine Kollegen die Hirnaktivität von vier Patienten mit chronischen Schmerzen auf neue Weise untersucht. Dafür implantierten sie den Schmerzpatienten feine Elektroden unter die Schädeldecke des Stirnbereichs. Die Elektroden waren so platziert, dass sie die Hirnaktivität in zwei Arealen des präfrontalen Cortex aufzeichneten, dem anterioren cingulären Cortex (ACC) und dem orbitofrontalen Cortex (OFC).
„Messungen mit funktionaler Magnetresonanztomographie zeigen, dass beide Areale bei akutem Schmerz aufleuchten“, sagt Shirvalkar. „Wir wollten herausfinden, ob diese Regionen auch bei der Verarbeitung von chronischem Schmerz eine Rolle spielen. Vor allem hat uns interessiert, ob es dabei Hirnsignale gibt, die mit der Intensität des Schmerzes zusammenhängen.“ Einer der Patienten litt unter Phantomschmerzen nach einer Amputation, bei den anderen drei war ein Schlaganfall der Schmerz-Auslöser.
Über drei bis sechs Monaten hinweg gaben die vier Testpersonen mehrfach am Tag mithilfe einer standardisierten Schmerzskala an, wie intensiv ihre chronischen Schmerzen waren. Zur jeweils gleichen Zeit zeichneten die Elektroden ihre Hirnaktivität auf. Das Team sammelte auf diese Weise drei bis sechs Monate lang Daten und wertete diese dann mithilfe eines lernfähigen Algorithmus aus.
Signal im orbitofrontalen Cortex
Das Ergebnis: Immer, wenn die Patienten unter stärkeren chronischen Schmerzen litten, registrierten die Elektroden ein spezifisches Muster ihrer Hirnaktivität. Je intensiver der Schmerz, desto höher war die im orbitofrontalen Cortex gemessene Aktivität. „Der chronische Schmerzzustand konnte bei allen Patienten signifikant auf Basis des jeweils gegenseitigen orbitofrontalen Cortex dekodiert werden“, berichten Shirvalkar und seine Kollegen. In geringerem Maße war auch der anteriore cinguläre Cortex (ACC) aktiviert.
Beide Messungen zusammen ermöglichten es dem Team, den Schmerz ihrer Probanden mit teilweise mehr als 80-prozentiger Sensitivität und Spezifität an deren Hirnaktivität abzulesen. „Diese Ergebnisse sind ein Machbarkeitsbeleg dafür, dass Signale von neuronalen Schlüsselregionen verwendet werden können, um klinisch relevante Schmerzzustände beim Menschen zu bestimmen“, konstatieren Shirvalkar und seine Kollegen.
Und noch etwas zeigte sich: Akuter und chronischer Schmerz erzeugen im Gehirn unterschiedliche Aktivitätsmuster, wie ergänzende Tests ergaben. Bei akuten Schmerzreizen wird vor allem der anteriore cinguläre Cortex aktiv und nur in geringem Maße der orbitofrontale Cortex. Beim chronischen Schmerz ist es umgekehrt. „Diese Beobachtung passt zu früheren Bildgebungsstudien, bei denen experimentelle Schmerzreize ebenfalls den ACC als Schlüsselknoten aktivierten“, schreiben die Forschenden.
Neue Chancen für Diagnose und Therapie
Damit eröffnen diese Ergebnisse erstmals die Möglichkeit, chronische Schmerzen objektiv zu messen und zu diagnostizieren. Zwar wurde diese Signatur bisher nur durch Elektroden innerhalb des Schädel gemessen. Shirvalkar und sein Team schließen aber nicht aus, dass die spezifischen Aktivitätsmuster auch über nichtinvasive Methoden nachweisbar sein könnten. Das könnte diese Methode dann auch für die klinische Praxis praktikabel machen.
Sollte dies der Fall sein, dann könnten die neuen Erkenntnisse auch neue Ansatzpunkte für eine Schmerztherapie eröffnen – beispielsweise durch tiefe Hirnstimulation oder sogar nichtinvasive Beeinflussung der Hirnaktivität. „Indem wir bessere Werkzeuge entwickeln, um die Schmerzreaktionen im Gehirn zu erforschen und potenziell zu beeinflussen, hoffen wir, Möglichkeiten zu finden, um das Leben von Menschen mit chronischen Schmerzen zu verbessern“, sagt Shirvalkar. (Nature Neuroscience, 2023; doi: 10.1038/s41593-023-01338-z)
Quelle: NIH/ National Institute of Neurological Disorders and Stroke