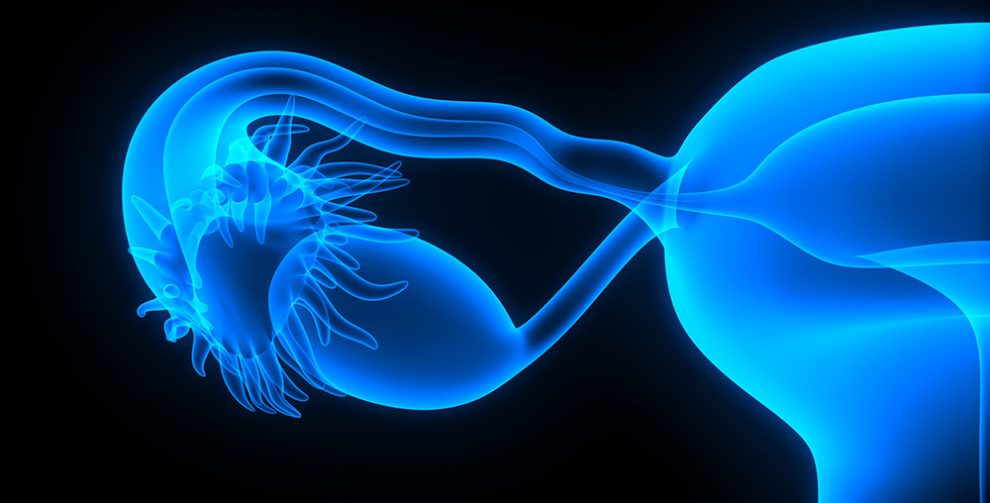
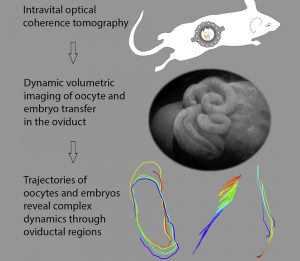
Wundersame Reise: Forscher haben erstmals Eizellen und Embryos live bei ihrer Wanderung durch den Eileiter beobachtet. Dies enthüllte, dass dieser für die Fortpflanzung entscheidende Transport weit dynamischer und komplexer abläuft als gedacht. Statt von den Cilien der Eileiterwand gleichmäßig vorwärtsgestrudelt zu werden, bewegen sich Eizellen und Embryo vor und zurück, drehen sich im Kreis oder werden von „Toren“ ausgebremst. So sorgt der Eileiter für das richtige „Timing“ bei Befruchtung und Einnistung.
Wenn es um die Befruchtung und Fortpflanzung geht, ist der Eileiter Handlungsort und Akteur zugleich. Denn in ihm finden sich Eizelle und Spermien, er transportiert den befruchteten Embryo in die Gebärmutter und bereitet ihn auf die Einnistung vor. Gleichzeitig stellt er dem Embryo die Umgebung zur Verfügung, die die ersten Entwicklungsschritte des neuen Lebens ermöglicht. Ist der Weg versperrt oder unterbleibt der aktive Transport von Eizelle und Embryo, scheitert die natürliche Reproduktion.
Doch trotz dieser enormen Bedeutung der Eileiter sind die Vorgänge in ihrem Inneren bislang kaum erforscht. „Niemand hat bisher gesehen, wie sich Eizellen und Embryos in den Eileitern eines lebenden Organismus bewegen“, sagt Irina Larina vom Baylor College of Medicine in Houston. „Diese Wissenslücke beruht vor allem darauf, dass es bislang keine geeigneten Bildgebungstechniken gab.“ Wie genau Eizelle und Embryo durch den Eileiter transportiert werden und welche Prozesse dabei zum Tragen kommen, war daher unklar.
Neue Bildgebung
Jetzt ist dieser Live-Blick in den intakten Eileiter erstmals gelungen. Dafür entwickelten Larina und der Biophysiker Shang Wang vom Stevens Institute of Technology in New Jersey eine spezielle Methodenkombination. Für die hochaufgelöste Bildgebung des Eileiterinneren setzen sie die Optische Kohärenztomografie (OCT) ein. Bei dieser werden Lichtstrahlen geteilt und eine Hälfte durch die Probe gestrahlt.
Das bei der Rekombination dieses Strahls mit dem Referenzstrahl entstehende Interferenzmuster ergibt dann das Bild. Für die OCT werden mehrere Scans zu einem dreidimensionalen Schnittbild kombiniert. „Wir haben bereits in vivo gezeigt, dass OCT die Strukturdetails des Eileiters mit einer Auflösung von rund fünf Mikrometern abbilden kann“, erklären die Forschenden.
Es gibt allerdings einen Haken: Die Optische Kohärenztomografie hat in Geweben nur eine Eindringtiefe von wenigen Millimetern. Um von außen in den Eileiter einer lebenden Maus zu schauen, mussten die Forschenden daher die darüberliegenden Haut- und Muskelschichten transparent machen. In ihrem Test erreichten sie dies, indem sie den Tieren ein kleines, per 3D-Druck spezielle angepasstes Klarsichtfenster implantierten.
Kreistanz der Eizellen
Dies ermöglichte es dem Team, erstmals dabei zuzuschauen, wie nur 70 Mikrometer kleine Eizellen und frisch befruchtete Embryos durch den millimeterdünnen Eileiter lebender Mäuse wanderten. Die Aufnahmen enthüllten gleich mehrere überraschende Details. Im oberen Eileiter sind die Eizellen noch von der Zona Pellucida, einer Schutzhülle aus Glykoproteinen, und einer Wolke von Hüllzellen umgeben.
Wie die OCT zeigte, bewegen sich diese Gebilde nicht linear, sondern rotieren: „Die Bewegung der Oocyten-Komplexe folgte wohldefinierten Kreisbahnen, auf denen sie einige Minuten für jeden Umlauf benötigten“, berichten Larina und Wang. „Unseres Wissens nach wurde diese Kreisbewegung der Eizell-Komplexe im oberen Eileiter zuvor noch nie dokumentiert – und ihre Funktion ist bisher unklar.“ Möglicherweise dient dies dazu, ein Ankleben der Eizellen an die Eileiterwand zu verhindern, so die Vermutung der beiden Forschenden.
Ein „Tor“ hilft beim Timing der Befruchtung
Interessant auch: Die Vorwärtsbewegung der Eizell-Komplexe wird zunächst von einer Art „Tor“ gebremst: Der vor ihnen liegende Teil des Eileiters ist kontrahiert und lässt zunächst nur Flüssigkeit durch, nicht aber die Eizellen. „Es war bemerkenswert, wie sich dann im Laufe von Stunden dieses ‚Tor‘ allmählich öffnete und die kreisende Wolke der Eizell-Komplexe langsam weiter in den unteren Eileiter wanderte“, schreibt das Team.
Die Wissenschaftler vermuten, dass dieses durch Muskelkontraktionen gebildete Tor dazu dient, die Wanderung der Eizellen im Eileiter abzubremsen. „Für die Befruchtung ist das Timing entscheidend und die Bildung dieses bremsenden Tores könnte den Spermien genügend Zeit verschaffen, durch die Gebärmutter und den Eileiter an Ort und Stelle zu gelangen“, mutmaßen Larina und Wang. „Würde sich dieses Tor nicht bilden oder wegen einer Muskeldysfunktion geschlossen bleiben, würden die Eizellen das richtige Zeitfenster für die Ankunft der Spermien verpassen.“
Komplexe Kombination von Transportmechanismen
Der Blick in den lebenden Eileiter lieferte auch neue Erkenntnisse über die Transportmechanismen von Eizellen und frühen Embryos: Im oberen Abschnitt des Ovidukts spielen demnach wie erwartet die Cilien der Eileiterwand die Hauptrolle für die Eizellbewegung. Im folgenden Abschnitt ändert sich dies jedoch. Dort beobachtete das Team erst eine schubweise Vor- und Zurückbewegung der Eizellen und Embryos, die vom periodischen Zusammenziehen des oberen Eileiterabschnitts angetrieben wird. Weiter unten treiben sie dann Wellen der peristaltischen Bewegung vorwärts.
„Überraschenderweise sorgen demnach verschiedenen miteinander kombinierte Bewegungsformen für den Transport von Eizellen und Embryos durch den Eileiter“, sagt Wang. „Dieser dynamische Prozess ist deutlich komplexer als bislang angenommen.“ Erst die Kombination von Cilienbewegung, Muskelkontraktion und Peristaltik sorgt dafür, dass Transport und Timing der Keimzellen stimmen.
Rückschlüsse auf mögliche Ursachen von Unfruchtbarkeit
„Unsere Ergebnisse deuten sie daraufhin, dass schon die Störung eines dieser verschiedenen Bewegungen entlang des Eileiters die Fortpflanzung beeinträchtigen könnte“, sagt Larina. „Wir hoffen, dass unsere Beobachtungen dazu beitragen können, unser Wissen über diesen wichtigen Schritt der Reproduktion zu verbessern und so auch mehr über die Störungen der Fortpflanzung zu erfahren.“ (Cell Reports, 2021; doi: 10.1016/j.celrep.2021.109382)
Quelle: Baylor College of Medicine