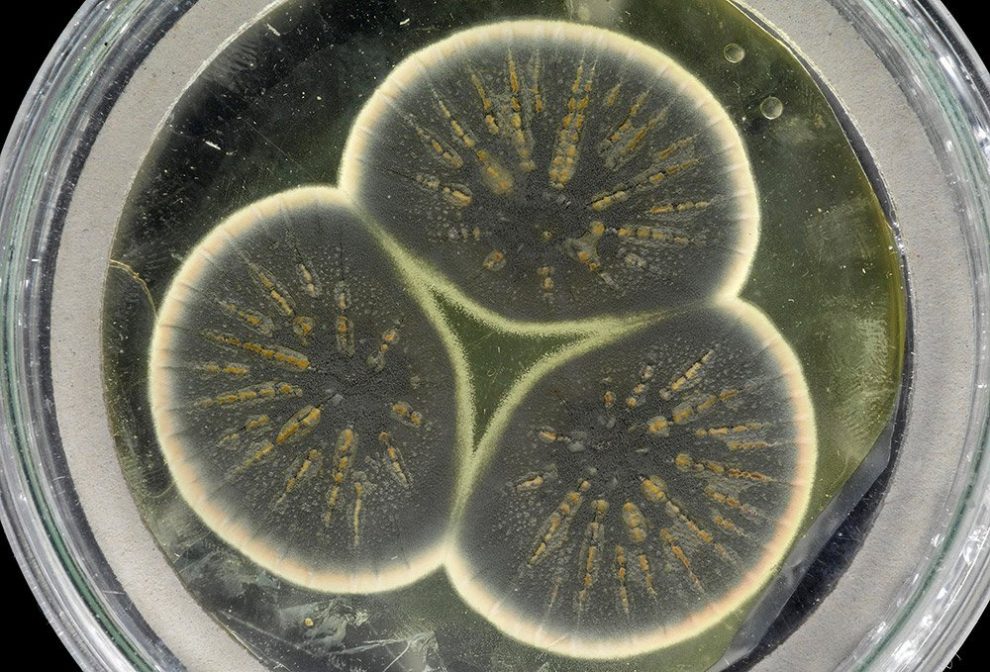
Legendärer Pilz: Vor fast 100 Jahren entdeckte Alexander Fleming mit dem Penicillin das erste Antibiotikum. Jetzt haben Forscher erstmals das Genom seiner Schimmelpilzkultur sequenziert – der Pilze, mit denen das Zeitalter der Antibiotika begann. Die DNA-Analysen enthüllen, dass dieser Ur-Stamm zwar den heutigen Industriestämmen von Penicillium rubens sehr ähnlich ist. Dennoch gibt es einige, möglicherweise entscheidende Unterschiede.
Die Ära der Antibiotika begann mit einem Zufall: 1928 ließ der britische Bakteriologe Alexander Fleming versehentlich eine Bakterienkultur mit Staphylokokken während seines Urlaubs im Labor liegen. Bei seiner Rückkehr stellt er fest, das sich ein Penicillium-Schimmelpilz auf dem Nährmedium ausgebreitet hat. Das Entscheidende jedoch: Im Umfeld des Pilzes sind alle Bakterien abgestorben. Fleming hatte den Wirkstoff Penicillin entdeckt – das erste Antibiotikum.

Reste der einst auf Flemings Petrischale gewachsenen Schimmelpilze existieren bis heute. Denn ein Teil seiner Originalkultur wurde vor gut 50 Jahren gefriergetrocknet, um diesen Stamm von Penicillium rubens für die Nachwelt zu konservieren. Für die Antibiotika-Produktion werden dagegen heute speziell gezüchtete Penicillium-Stämme eingesetzt, die eine möglichst hohe Ausbeute an Penicillin produzieren.
Erster Blick ins Erbgut von Flemings Pilzstamm
Doch nun haben britische Forscher Flemings Pilzstamm zu neuem Leben erweckt. „Eigentlich wollten wir Alexanders Flemings Penicillium für ein ganz anderes Experiment verwenden“, sagt Seniorautor Timothy Barraclough vom Imperial College London. „Doch dann stellten wir zu unserer Überraschung fest, dass noch niemand das Genom dieses Original-Penicilliums sequenziert hatte – trotz seiner historischen Bedeutung.“