Patentrezept der Natur: In unseren Gelenken gleiten Knorpel fast reibungsfrei aufeinander – besser als bei jedem Maschinenteil. Den Grund für diese sogenannte Superlubrizität haben Forschende nun geklärt. Demnach sorgen geladene Moleküle in der Gelenkflüssigkeit dafür, dass der schmierende Wasserfilm am Knorpel haftet und auch unter Druck nicht verloren geht. Je mehr dieser Moleküle im Gelenk präsent sind und je stärker belastet sie sind, desto glatter ist der reibungsmindernde Flüssigkeitsfilm.
Ob Schaltgetriebe, Motor oder Fahrradnarbe: Wenn sich bewegliche Teile aneinander vorbeibewegen, ist jede Reibung hinderlich. Sie kostet Energie, hemmt die Bewegung und kann zu erhöhtem Verschleiß führen. Ähnlich ist es auch bei unseren Gelenken. In ihnen löst die Natur das Reibungsproblem auf bewundernswert effektive Weise: Die Knorpelschicht sorgt in Verbindung mit der Gelenkflüssigkeit dafür, dass die Reibung extrem gering ausfällt – sie ist um Größenordnungen kleiner als bei beweglichen Teilen einer Maschine.
Die Kombination machts
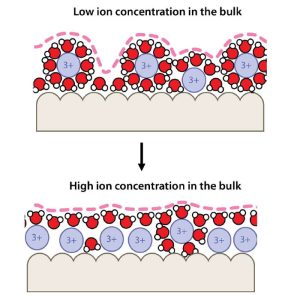
Aber warum? Und wie schaffen es unsere Gelenke, dass die Reibung selbst unter hoher Belastung so gering bleibt? Das hat nun ein internationales Forschungsteam um Tianyi Han von der chinesischen Tsinghua Universität näher untersucht. Im Zentrum standen dabei Grenzflächeneffekte zwischen dem Gelenksknorpel und der Gelenkflüssigkeit. Sie sorgen dafür, dass die Wassermoleküle dauerhaft an Ort und Stelle bleiben und wie ein schützendes Gleitpolster wirken.
„Die Frage ist, wie es dem Körper gelingt, diesen Flüssigkeitsfilm auch unter Last stabil zu halten – das bezeichnet man als Superlubrizität“, erklärt Koautor Markus Valtiner von der TU Wien. „Die genauen Mechanismen werden seit Jahren heiß diskutiert, aber es gab bisher schon den Verdacht, dass positiv geladene Kationen dabei eine entscheidende Rolle spielen könnten.“ Demnach könnten im Wasser gelöste Ionen als „Bindemittel“ wirken, das die polaren Wassermoleküle an die oft negativ geladenen biologischen Oberflächen koppelt.