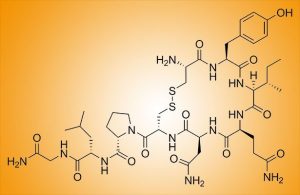
Das „Kuschelhormon“ Oxytocin stärkt nicht nur emotionale Bindungen – es hat offenbar auch eine heilende Wirkung auf das Herz, wie Forschende herausgefunden haben. Demnach bringt eine verstärkte Ausschüttung von Oxytocin bestimmte Zellen der Herzwand dazu, sich wieder in Stammzellen umzuwandeln. Diese unreifen Vorläuferzellen können dann neue Herzmuskelzellen bilden und so geschädigte Herzteile reparieren helfen – das könnte neue Ansätze für die Regeneration nach einem Herzinfarkt liefern.
Anders als andere Muskeln besitzt unser Herzmuskel nur geringe Selbstheilungskräfte. Wird er durch einen Herzinfarkt oder eine Verletzung geschädigt, heilt er nur schwer und oft bleibt eine Herzschwäche zurück. Das liegt unter anderem daran, dass es im Herzen kaum Stammzellen gibt, aus denen sich neue Cardiomyocyten bilden könnten. Allerdings gibt es erste Hinweise darauf, dass sich Zellen aus der Herzwand, dem Epikard, unter bestimmten Bedingungen zu Stammzellen rückentwickeln können – und dann neue Herzmuskelzellen bilden.
Unerwartete Wirkung des Kuschelhormons
Einen entscheidenden Faktor für diese Regeneration haben nun Aaron Wasserman und seine Kollegen von der Michigan State University entdeckt: das Hormon Oxytocin. Den Anstoß für ihre Studie gab die Beobachtung, dass Zebrafische anders als wir Menschen kein Problem mit der Herzregeneration haben: Wird ihr Herz verletzt, wächst der Herzmuskel mitsamt seinen Gefäßen schnell wieder nach. Dies geschieht, indem massenweise Zellen aus der Herzwand in Epikard-abgeleitete Vorläuferzellen (EpiPC) umgewandelt werden.
Als die Forschenden nach dem Anstoß für diese Umwandlung suchten, entdeckten sie im Gehirn der Zebrafische Überraschendes: Als Reaktion auf die Herzverletzung wurden dort große Menge des „Kuschelhormons“ Oxytocin ausgeschüttet. Die Boten-RNA für die Produktion dieses Hormons stieg dadurch im Zebrafischgehirn in kurzer Zeit um das 20-Fache an. Doch das Hormon blieb nicht im Gehirn: Es wanderte mit dem Blut in das Herz und löste dort eine molekulare Kaskade aus, die die Umwandlung der Epikard-Zellen in die Stammzellen initiierte.
Funktioniert auch bei menschlichen Zellkulturen
Das wirft die Frage auf, ob dieser Mechanismus auch beim Menschen funktionieren könnte. Zwar löst ein Herzinfarkt oder eine Herzverletzung bei uns keinen solchen Oxytocin-Schub aus, dennoch wäre denkbar, dass die molekularen Reaktionen auf das Kuschelhormon auch bei uns noch erhalten sind. Um das zu testen, züchteten Wassermann und sein Team menschliche Herzwandzellen in Kultur und setzten sie Oxytocin sowie zum Vergleich 14 anderen Neuro-Botenstoffen aus.
Das überraschende Ergebnis: Auch die menschlichen Herzzellen reagierten auf das Kuschelhormon. Während die anderen Botenstoffe wenig bewirkten, wandelten sie sich unter Einfluss des Oxytocins vermehrt in Epikard-abgeleitete Vorläuferzellen um. Nähere Analysen ergaben, dass diese Zellen dafür eigene Oxytocin-Rezeptoren besitzen, an die das Kuschelhormon andockt und so die Umwandlung anstößt.
Hoffnung auf Potenzial für die Medizin
„Damit haben wir gezeigt, dass Oxytocin Mechanismen zur Herzreparatur in Zebrafischen und in menschlichen Zellkulturen aktivieren kann“, sagt Seniorautor Aitor Aguirre. „Offenbar ist diese Reaktion auf die Oxytocin-Stimulation auch bei den menschlichen Herzzellen in gewissem Maße erhalten geblieben.“ Das könnte neue Möglichkeiten schaffen, die Regeneration des Herzens nach einem Herzinfarkt oder einer Verletzung auch beim Menschen gezielt zu fördern – indem beispielsweise zusätzliches Oxytocin verabreicht wird.
„Oxytocin wird in der Medizin aus anderen Gründen schon länger eingesetzt“, erklärt Aguirre. „Es nun auch bei Patienten nach einem Herzinfarkt zu verwenden, ist daher keineswegs utopisch. Selbst wenn dies nur zu einer teilweisen Regeneration des Herzens führen würde, wäre der Nutzen für die Patienten enorm.“ Bis es allerdings so weit ist, müssen der biochemische Mechanismus und die mögliche Therapie erst noch bei Säugetieren näher untersucht werden. (Frontiers in Cell and Developmental Biology, 2022; doi: 10.3389/fcell.2022.985298)
Quelle: Frontiers