Hohe Grundlast: Selbst im Schlaf oder Koma hat unser Gehirn einen enormen Energieverbrauch – aber warum? Eine Antwort auf dieses Rätsel könnten Forscher nun gefunden haben. Demnach sind die winzigen Bläschen an den Synapsen schuld, die bei Erregung Botenstoffe zur Nachbarzelle bringen. Diese Vesikel sind in Ruhe schon gefüllt, verlieren aber über ihre Membranen ständig Protonen und damit Energie, wie die Wissenschaftler herausfanden.
Unser Gehirn ist das energiehungrigste Organ im Körper: Obwohl es nur gut zwei Prozent unseres Körpergewichts ausmacht, verbraucht es rund 20 Prozent unserer Energie. Der Großteil davon wird für die aktive Kommunikation der Nervenzellen über elektrische und chemische Signale benötigt. Doch seltsamerweise sinkt der Energiebedarf unseres Denkorgans selbst in völliger Ruhe oder im Koma nur wenig ab. Unter anderem deshalb reagiert das Gehirn so sensibel schon auf kurze Unterbrechungen der Blutversorgung.
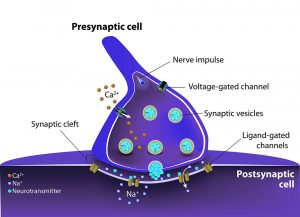
Genauerer Blick auf die Synapse
Aber wofür benötigt das ruhende Gehirn diese Energie? Camila Pulido und Timothy Ryan vom Weill Cornell Medical College in New York hatten dafür die Synapsen im Verdacht – die Schaltstellen zwischen den einzelnen Nervenzellen, an denen elektrische Signale in chemische Botenstoffe übersetzt und über den synaptischen Spalt zwischen den Zellen transportiert werden.
Die Hirnzelle verpackt diese Neurotransmitter in winzige Bläschen, die dann solange „auf Vorrat“ angedockt bleiben, bis ein elektrischer Impuls ihre Freisetzung auslöst. Aus früheren Studien ist bekannt, dass das Packen und Nachfüllen dieser Vesikel viel Energie verbraucht und daher beim aktiven Gehirn einen großen Anteil am gesamten Hirnstoffwechsel hat. Wie dies bei den in Warteposition ruhenden synaptischen Vesikeln aussieht, haben nun Pulido und Ryan erstmals näher untersucht.
Dafür kultivierte das Team Hirnzellen und Synapsen im Labor und untersuchten ihren Ruhestoffwechsel mithilfe von Fluoreszenzmarkern und gezielter Blockade der Energiezufuhr in Form von ATP oder einzelner Prozessschritte.
Protonenleck in der Vesikelmembran
Die Experimente enthüllten: Auch wenn die Synapsen nicht aktiv sind, benötigen die dort gelagerten Vesikel tatsächlich ständig Nachschub an chemischer Energie in Form des Moleküls Adenosintriphosphat (ATP). Wie die Forschenden feststellten, ist das Enzym V-ATPase nicht nur beim Befüllen der Vesikel mit Neurotransmittern aktiv, sondern auch, wenn die Bläschen fertig gepackt sind und eigentlich nichts passiert. Aber warum?
Nähere Analysen enthüllten, dass das die Membranen der winzigen Neurotransmitter-gefüllten Bläschen offenbar nicht ganz „dicht“ sind: Sie verlieren ständig Protonen an ihre Umgebung. „Dieser Verlust muss dann wiederum durch die V-ATPase ausgeglichen werden, die dafür ständig ATP verbraucht“, erklärt das Team. Ursache für dieses Leck ist dabei ein Transportermolekül in der Vesikelmembran, das normalerweise die Botenstoffe in die Bläschen schleust, aber dafür offenbar leicht Protonen nach außen durchlässt.
Hohe Grundlast selbst in Ruhe
„Unsere Daten zeigen, dass dieser konstante Protonenausstrom für rund 44 Prozent des ATP-Verbrauchs einer ruhenden Synapse verantwortlich ist“, berichten Pulido und Ryan. „Angesichts der enormen Zahl solcher Nervenenden im Gehirn und der Tatsache, dass dieser Energieverbrauch ständig anhält, bedeutet das eine substanzielle Grundlast für das Gehirn.“ Schätzungen zufolge gibt es in unserem Gehirn hunderte Billionen von Synapsen, die rund um die Uhr ATP und damit Energie verbrauchen.
„Unsere Studie liefert damit eine überzeugende Erklärung dafür, warum unser Gehirn selbst in Ruhe einen so viel höheren Grundumsatz hat als andere Gewebe“, schreiben die beiden Forschenden. „Gleichzeitig erklärt es auch, warum diese Nervenendigungen so anfällig gegenüber Versorgungsengpässen sind.“
Hilfe gegen Hirnschäden?
Das Wissen um den Prozess, der für den hohen synaptischen Energieverbrauch verantwortlich ist, könnte nun Wege aufzeigen, das Gehirn besser vor Schäden durch eine unterbrochene Blutversorgung zu schützen. Wie dies gelingen könnte, haben Pulido und Ryan zumindest in der Gewebekultur bereits ausprobiert: Sie blockierten das protonenleckende Transportermolekül und testeten dann, wie gut die Synapsen bei Abschneiden der Energiezufuhr noch funktionierten.
Es zeigte sich: Während Kontrollsynapsen schon nach wenigen Nervenimpulsen versagten, hielten die Nervenenden mit blockiertem Transporter 50 Prozent länger durch. Zwar konnten auch sie wegen des deaktivierten Transporters keine neuen Vesikel befüllen, dafür blieben aber die schon gepackten länger einsatzbereit, wie das Team feststellte. Sollte eine solche Strategie auch im lebenden Organismus funktionieren, könnte dies bei Schlaganfällen oder Herzstillstand wertvolle Zeit gewinnen helfen. (Science Advances, 2021; doi: 10.1126/sciadv.abi9027)
Quelle: Weill Cornell Medicine