Krebs durch Krebstherapie? Chemotherapeutika schädigen neben Tumorzellen auch vormals gesunde Zellen – und können so beispielsweise Leukämie auslösen. Forscher haben nun herausgefunden, dass platinhaltige Chemotherapeutika typische Mutationsmuster bei Blutzellen verursachen. Bei anderen Chemotherapeutika fehlten diese Signaturen, dafür zeigte sich ein enger Zusammenhang zwischen der Dauer der Behandlung und therapiespezifischen Mutationen in späteren Metastasen.
Einige Chemotherapeutika bekämpfen Tumorzellen, indem sie ihre DNA schädigen und auf diese Weise die Zellteilung stören. Die schnell wachsenden Tumorzellen sind daher stärker von der Chemotherapie betroffen als gesunde Körperzellen. Doch auch diese können Schäden davontragen, indem sie beispielsweise Mutationen entwickeln. Sind davon Blutstammzellen im Knochenmark betroffen, kann sich einige Jahre nach der Chemotherapie eine Leukämie entwickeln. Dabei entarten unreife Blutvorläuferzellen und vermehren sich ungebremst.
Mutationsmustern auf der Spur
„Bisher war unklar, ob die Fälle von Leukämie nach Chemotherapien speziell durch medikamentenbedingte Mutationen hervorgerufen werden oder ob sie eine Folge des evolutionären Engpasses sind, den Chemotherapien für die Blutbildung darstellen, oder ob beide Faktoren zusammenspielen“, schreibt ein Team um Oriol Pich vom Barcelona Institut für Wissenschaft und Technologie in Spanien.
Von Krebszellen wussten die Forscher bereits, dass einige Chemotherapeutika bestimmte Mutationsmuster in der DNA hinterlassen, die wie ein Fußabdruck den Einfluss des Medikaments verraten. „Wir haben daher vermutet, dass der Nachweis des Mutationsfußabdrucks von Chemotherapien auch bei therapiebedingter Leukämie ein leistungsfähiges Instrument zur Untersuchung ihres Einflusses auf solche Erkrankungen darstellt“, so die Forscher.
Fußabdruck der Platin-Chemotherapie
Pich und sein Team untersuchten dazu die Gensequenzen bei 30 Fällen von therapiebedingter Leukämie und 32 Fällen, in denen die Leukämie ohne eine vorangegangene Chemotherapie entstanden ist. „Von den Patienten mit therapiebedingter Leukämie hatten acht in der Vergangenheit eine platinbasierte Chemotherapie erhalten, beispielsweise mit Cisplatin, Oxaliplatin oder Carboplatin“, berichten die Forscher. „Bei allen von ihnen stellten wir den Mutationsfußabdruck des Medikaments in den entarteten Blutzellen fest.“
Bei Patienten, die andere Chemotherapeutika erhalten hatten, darunter beispielsweise 5-Fluoruracil, stellten die Forscher dagegen kein solches Mutationsmuster in den Blutzellen fest – und das obwohl auch diese Medikamente mit dem Auftreten von Leukämie assoziiert sind.
Grund dafür ist wahrscheinlich der unterschiedliche Wirkmechanismus dieser Mittel: Während platinbasierte Chemotherapien die DNA von Zellen direkt schädigen, verändert 5-Fluoruracilen nur die DNA-Bausteine, die die Zellen für die Produktion neuer Erbgutkopien benötigen. Diese Zellen werden daher nur dann geschädigt, wenn sie sich im Laufe der Chemotherapie teilen und die geänderten Nukleotide einbauen.
Auch die Dauer kann entscheidend sein
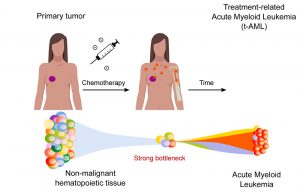
Und noch ein Faktor kommt zum Tragen, wie Pich und seine Kollegen in einer ergänzenden Studie mit mehr als 700 Krebspatienten feststellten. Diese Patienten waren für ihre Primärtumore mit platinbasierten Mitteln oder 5-Fluoruracil behandelt worden, hatten aber einige Jahre später Metastasen entwickelt. Auch bei diesen Probanden analysierten die Forscher das Genom und die therapiespezifischen Mutationsmuster der Krebszellen.
Es zeigte sich: Nach der 5-Fluoruracil-Behandlung stieg die Wahrscheinlichkeit für Krebszellen mit therapiespezifischen Mutationen, je länger die Chemotherapie angehalten hatte. Bei platinbasierten Mitteln war dies nicht der Fall. Eine mögliche Erklärung dafür: „Diese durch 5FU hervorgerufenen Mutationen treten nur dann auf, wenn der Pool der DNA-Bausteine zum Zeitpunkt der Zellteilung nicht wieder regeneriert war“, so Pich und sein Team. „Das ist umso wahrscheinlicher, je länger die Zellen dem 5-Fluoruracil ausgesetzt sind.“
Was Blutzellklone verraten
Zusätzlich untersuchten die Forscher auch die sogenannte klonale Hämatopoese. Dabei führen Mutationen in Blutstammzellen dazu, dass sich einzelne dieser Stammzellen stärker vermehren als andere und zahlreiche Klone bilden. Diese können je nach Erbgutzustand harmlos sein, aber auch Leukämie begünstigen oder beispielsweise das Risiko für Herz-Kreislauf-Erkrankungen erhöhen. „Unsere Studie ermöglicht es uns, zu unterscheiden, ob die klonale Hämatopoese bereits vor der Behandlung mit Chemotherapie begonnen hat, und somit eine zeitliche Beziehung herzustellen“, sagt Pich.
Das Ergebnis: Während klonale Expansionen, die zu Leukämie führten, erst nach der Chemotherapie stattfanden und wahrscheinlich durch die Medikamente verursacht wurden, existierten Blutzellklone, die für eine klonale Hämatopoese sorgten, bereits vor Beginn der Therapie. Ihre Mutationen halfen ihnen offenbar, der Chemotherapie zu entgehen, sodass sie sich in der Folge verstärkt entwickeln konnten. Hier spielte also ein Flaschenhalseffekt eine Rolle, wie das Team erklärt.
„Zusammenfassend lässt sich sagen, dass unsere Ergebnisse die Nützlichkeit bestimmter Mutationssignaturen belegen, wie beispielsweise derjenigen, die mit der Exposition gegenüber Chemotherapien verbunden sind“, schreiben die Forscher. „Unsere Studie eröffnet einen Weg, einige der längerfristigen Auswirkungen zu erforschen, die die Exposition gegenüber solchen zytotoxischen Behandlungen bei Krebsüberlebenden verursacht.“ (Nature Communications, 2021, doi: 10.1038/s41467-021-24858-3)
Quelle: Institute for Research in Biomedicine – IRB