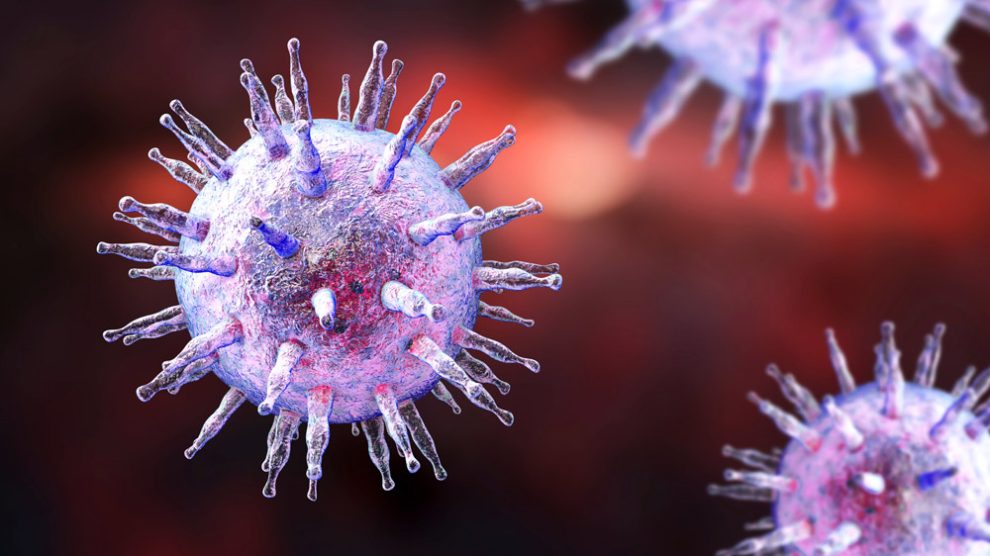
Fatales Andocken: Schon länger gilt das Epstein-Barr-Virus als potenziell krebserregend. Wie das Virus unsere Zellen zur Entartung bringt, haben Forschende nun aufgedeckt. Demnach docken virale Proteine an eine besonders fragile Stelle unseres Chromosoms 11 an und verursachen dort Brüche. Das wiederum begünstigt die Krebsentstehung, wie das Team in „Nature“ berichtet. Die neuen Erkenntnisse eröffnen nun die Chance, diese Entartung gezielt zu verhindern und auch, besonders gefährdete Menschen zu identifizieren.
Rund 90 Prozent von uns tragen das Epstein-Barr-Virus (EBV) in sich – meist unbemerkt und seit der frühen Kindheit. Doch in manchen Fällen kann der zu den Herpesviren gehörende Erreger krankmachen: Er verursacht das Pfeiffersche Drüsenfieber und steht im Verdacht, Multiple-Sklerose, Long Covid und das Chronische Fatigue Syndrom zu fördern. Außerdem gilt EBV als mögliche Ursache mehrerer Krebserkrankungen, darunter dem Hodgkin-Lymphom und Hals-Rachen-Krebs.
Virales Protein im Visier
Doch wie kann das Epstein-Barr-Virus einen Krebstumor verursachen? Den Mechanismus dahinter könnten nun Julia Su Zhou Li von der University of California in San Diego und ihre Kollegen entdeckt haben. Sie waren einer bekannten Eigenheit des Virus nachgegangen: EBV hinterlässt in infizierten Zellen das virale Protein EBNA1. Dieses bindet in einer Art Rückkopplung an eine bestimmte DNA-Sequenz im Genom des Virus, kann sich aber auch an die menschliche DNA anlagern.
An diesem Punkt setzt die Studie von Li und ihrem Team an: Mithilfe verschiedener menschlicher Zellkulturen untersuchten sie, wo genau das Virus-Protein im Erbgut andockt. Dabei entdeckten sie eine auffallende Häufung von angelagerten EBNA1-Proteinen in einem Abschnitt des Chromosoms 11. Nähere Analysen ergaben, dass das Erbgut dort zahlreiche Kopien einer DNA-Sequenz enthält, die der Andocksequenz im Epstein-Barr-Gencode gleichen. Dies ermöglicht es dem viralen EBNA1-Protein, an unserer DNA anzudocken.