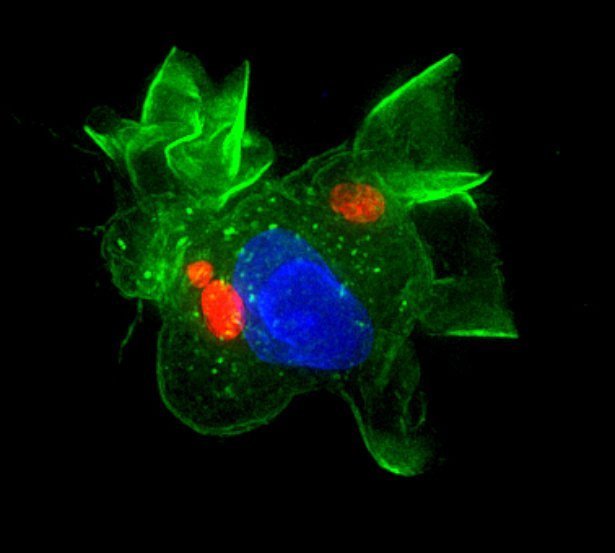
Zum Ziel im trojanischen Pferd: Forscher haben herausgefunden, wie der Toxoplasmose-Erreger unerkannt in unser Gehirn gelangt. Demnach kapert der parasitische Einzeller Immunzellen, die ihn dann bereitwillig bis ins Gehirn tragen – anstatt ihn zu eliminieren. Seine Befehle gibt der Eindringling dabei offenbar über Kalziummoleküle weiter. Diese docken an Rezeptoren auf der Oberfläche der Immunzellen an und verändern dadurch deren Verhalten.
Unbemerkt, aber überall: Nach Schätzungen von Experten trägt weltweit jeder dritte bis jeder zweite den Erreger Toxoplasma gondii in seinem Körper – meist ohne etwas davon zu spüren. Der Parasit befällt eigentlich hauptsächlich Katzen, breitet sich aber auch unter anderen Arten aus. Eine Ansteckung beim Menschen erfolgt meist über den Kontakt mit Katzenkot, kontaminiertes Wasser, Gemüse oder nicht durchgegartes Fleisch.
Für Personen mit einem geschwächten Immunsystem und ungeborene Babys im Mutterleib kann die Infektion mitunter lebensgefährlich werden. Bei gesunden Angesteckten ruft die Toxoplasmose jedoch nur milde Symptome hervor und bleibt in der Regel unbemerkt. Langfristig zieht jedoch auch eine vermeintlich folgenlose Infektion womöglich schwere Konsequenzen nach sich, wie jüngste Studien nahelegen. So scheint der Erreger schleichend mentale Veränderungen herbeiführen und Störungen wie Demenz oder Depressionen fördern zu können.
Torwächter ausgeschaltet
Der Grund: Toxoplasma gondii ist dazu in der Lage, die Blut-Hirnschranke zu passieren und sich lebenslang in Nervenzellen einzunisten. Wie aber gelingt ihm das? Dieser Frage sind nun Wissenschaftler um Sachie Kanatani von der Universität Stockholm nachgegangen. Bei einer Reihe von Experimenten mit Zellen von Mäusen fanden sie heraus, wie der Parasit die Torwächter des Immunsystems, die dendritischen Zellen, manipuliert.
Wenn wir uns infizieren, landet der Erreger normalerweise zunächst in unserem Magen und anschließend im Darm. Dort passiert er die Zellwand – und müsste eigentlich von den Immunzellen bemerkt und getötet werden, die dann auch weitere Bestandteile des Immunsystems in Alarmbereitschaft versetzen. Doch das passiert nicht.
Kalzium als Schlüsselsignal
Stattdessen übernimmt der Parasit die Kontrolle über die Zellen und nutzt sie für seine Zwecke aus: „Er macht sie gewissermaßen zu willenlosen Zombies, die ihn bereitwillig durch den gesamten Körper und bis ins Gehirn transportieren“, berichtet Kanatanis Kollege Antonio Barragan. So verändern die Immunzellen durch die Infektion mit dem Erreger ihr Migrationsverhalten und werden zu einem trojanischen Pferd, in dem der Eindringling unbemerkt durchs Feindesland getragen wird.
Seine Befehle an die Zelle gibt der Erreger dabei über Kalziummoleküle weiter, wie die Forscher herausfanden. Diese docken an einen speziellen Rezeptor auf den Immunzellen an. Dieser Signalempfänger war auf dendritischen Zellen bisher unbekannt – er scheint aber eine wesentliche Rolle für die Kommunikation zwischen Parasit und Immunzelle zu spielen. Über ihn wird eine Signalkaskade in Gang gesetzt, die die Zelle dazu anregt, den Neurotransmitter GABA zu produzieren und durch den Körper bis ins Gehirn zu wandern.
Ansatz für neue Therapien?
Interessanterweise scheint dieser Signalweg durch gängige Medikamente gegen Bluthochdruck unterdrückt werden zu können, wie weitere Experimente zeigten: „Verabreichten wir Mäusen solche Mittel, verbreitete sich der Parasit nicht weiter in ihrem Körper“, sagt Barragan.
Ob sich Bluthochdruckmittel eines Tages tatsächlich als wirksames Mittel gegen die Toxoplasmose entpuppen könnten, ist zwar unklar. Die neuen Erkenntnisse helfen den Wissenschaftlern jedoch, die Tricks und Ausbreitungsstrategien des Erregers besser zu verstehen. „Und das wird uns langfristig hoffentlich zu effektiven Behandlungsmöglichkeiten führen“, schließt Barragan. (Plos Pathogens, 2017; doi: 10.1371/journal.ppat.1006739)
(Stockholm University, 11.12.2017 – DAL)