Bei vielen Tumoren ist das krebsauslösende Ras-Protein dauerhaft "angeschaltet", so dass die Zellen unkontrolliert wachsen. Wie die Abschaltung des Ras-Proteins im Detail funktioniert, hat jetzt ein deutsches Forscherteam herausgefunden. Das Verständnis des molekularen Mechanismus des Eiweißes liefert nach Angaben der Wissenschaftler die Voraussetzung für die Entwicklung molekularer Therapien bei Krebserkrankungen.
Das Ras-Protein ist der Schalter für das Zellwachstum: Wird es durch bestimmte Mutationen verändert (onkogen), dann steht der Schalter für das Zellwachstum dauerhaft auf "an" und die Zelle wächst unkontrolliert. Onkogenes Ras findet man in 25 Prozent aller menschlichen Tumore. "Um das unkontrollierte Wachstum zu stoppen, muss also der Abschaltprozess des Ras-Proteins genau verstanden werden", so Professor Klaus Gerwert von der Ruhr-Universität Bochum, der zusammen mit seinem Kollegen Carsten Kötting und den Professoren Roger Goody und Alfred Wittinghofer vom Max Planck-Institut für molekulare Physiologie genau diesen Mechanismus entschlüsselt hat. Auf „aus“ gestellt wird das Ras durch die Katalyse des Triphosphats GTP zu Diphosphat GDP.
Enzymatischen Weg wie im Film beobachten
Die jetzt im US-Wissenschaftsmagazin Proceedings of the National Academy of Sciences (PNAS) veröffentlichte spektroskopische Arbeit ergänzt die früheren Arbeiten der Dortmunder Wissenschaftler, die bereits die Raumstrukturen des Ras-Proteins und seinem Interaktionspartner, dem GAP, aufgeklärt haben.
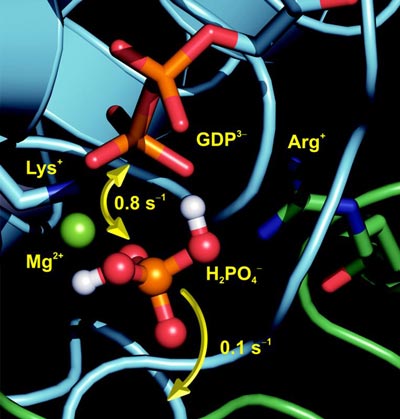
Mit der so genannten trFTIR-Technik (time-resolved Fourier Transform Infrared) der Bochumer Biophysik konnten die Forscher jetzt den enzymatischen Weg der durch das Protein GAP katalysierten GTPase-Reaktion des Ras-Proteins wie in einem Film beobachten. Dabei konnten sie ein bisher nicht charakterisiertes, proteingebundenes Phosphat mit nur Millisekunden Lebenszeit identifizieren, seine Position im Protein und seinen Protonierungszustand bestimmen.
"Bislang war bekannt, dass im 'an'-Zustand das Triphosphat GTP an das Protein gebunden ist und im 'aus'-Zustand das Diphosphat GDP", erklärt Prof. Gerwert. "Jetzt konnten wir mit der trFTIR beobachten, dass der Schalter in dieser neu entdeckten Zwischenstufe leicht wieder in den 'an'-Zustand 'zurückschnappen' kann." Die daran beteiligten Protonen sind entscheidend für den Reaktionsmechanismus. Die Forscher vermuten, dass eine solche Zwischenstufe auch in anderen GTPasen und ATPasen eine wichtige Rolle spielt.
Direkt am Protein wirksame Medikamente entwickeln
Die Entdeckungen über das Ras-Protein könnten für zukünftige Krebsmedikamente von Bedeutung sein: Während klassische Chemotherapeutika als Zellgift wirken und somit starke Nebenwirkungen haben, versucht man heute für die Krebstherapie Medikamente zu entwickeln, die direkt und ausschließlich an einem solchen onkogenen Protein wirken. Mit dem erworbenen Wissen kann man jetzt versuchen, mit maßgeschneiderten Substanzen das onkogene Ras in den "aus"-Zustand zu zwingen, indem man das "Zurückschnappen" verhindert. Im "an"-Zustand interagiert das Ras mit der Raf-Kinase. Kürzlich hat Bayer für eine maßgeschneiderte molekulare Therapie ein Medikament entwickelt, das als so genannter Raf-Kinase-Hemmer bei Nierenkrebs erfolgreich eingesetzt wird.
Auch ein methodischer Durchbruch
Auch methodisch stellt die Arbeit einen Durchbruch dar, weil mit Hilfe von Isotopenmarkierungen die dipolare Wechselwirkung zwischen zwei molekularen Gruppen, hier dem Pi und dem GDP, in einem Protein nachgewiesen wurde. Somit konnte zum ersten Mal aus einem eindimensionalen Infrarotspektrum ein Abstand bestimmt werden, analog der Vorgehensweise in der Festkörper-NMR- und der ESR-Spektroskopie. Mit dem Ansatz können in Zukunft nicht nur Reaktionsmechanismen, sondern auch Abstandsänderungen mit hoher Zeitauflösung vermessen werden.
(idw – Ruhr-Universität Bochum, 20.09.2006 – DLO)