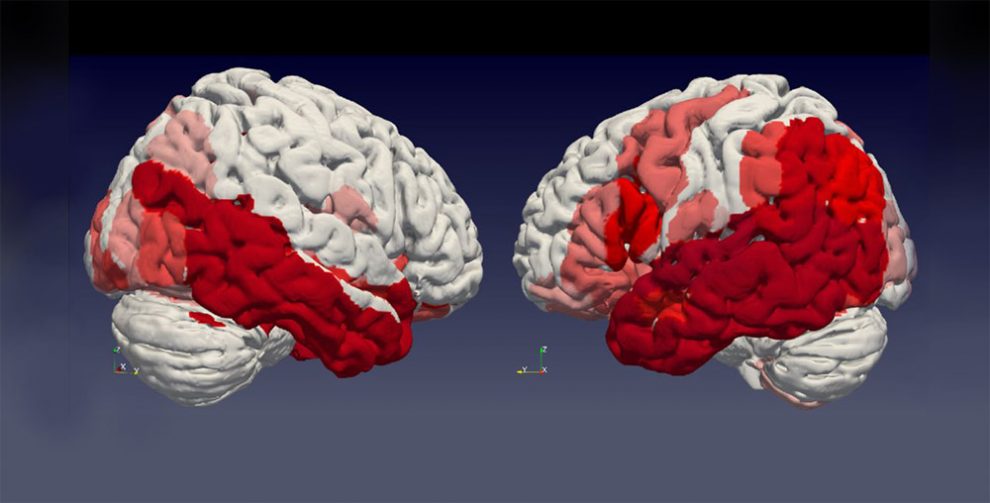
Muster der Zerstörung: Mediziner haben erstmals anhand von Hirnscans mitverfolgt, wie sich die Parkinson-Krankheit im Gehirn ausbreitet. Sie konnten sehen, wie im Laufe der Zeit immer mehr Hirnregionen vom Abbau grauer Hirnsubstanz betroffen waren und in welcher Abfolge der Schwund sich manifestierte. Die Beobachtungen belegen auch, dass das Absterben der Hirnzellen dem gleichen räumlichen Muster folgt wie die Ausbreitung fehlgefalteter Proteine im Gehirn.
Parkinson ist die zweithäufigste neurodegenerative Erkrankung nach Alzheimer. Typisch dafür ist eine Anreicherung von fehlgefalteten Proteinen, dem sogenannten Alpha-Synuclein im Gehirn. Diese verklumpten Proteine wiederum verursachen ein fortschreitendes Absterben von Dopamin-produzierenden Neuronen. Weil dieser wichtige Neurotransmitter fehlt, erzeugt dies die für Parkinson typischen Symptome wie Zittern, verlangsamte, verkleinerte Bewegungen, aber auch kognitive Einbußen und schließlich Demenz.
Parkinson-Patienten ins Gehirn geschaut
Gängiger Annahme nach breiten sich die Alpha-Synucleine dabei nach einem festen Muster im Gehirn aus: Die Verklumpung beginnt im Hirnstamm und Riechkolben, setzt sich dann über Mittelhirn und die Substantia nigra fort bis in die Großhirnrinde. Dort breitet sich das Alpha-Synuclein vom sensorischen Cortex über den präfrontalen Cortex bis in die primären Sinnesareale und den für die Bewegungssteuerung zuständigen motorischen Cortex aus.
Bisher war aber strittig, ob dieses Ausbreitungsmuster der verklumpten Proteine auch dem Abbau der Hirnsubstanz entspricht und die fortschreitenden Parkinsonsymptome erklären kann. Einige Studien schienen einem solchen Ablauf zu widersprechen. Deshalb haben nun Peter Pieperhoff vom Forschungszentrum Jülich und seine Kollegen die Veränderungen des Gehirns bei 37 Parkinson-Patienten und 27 gesunden Vergleichspersonen gleichen Alters über neun Jahre hinweg verfolgt. Mithilfe der Magnetresonanztomografie kartierten sie regelmäßig den Zustand der Hirnsubstanz.
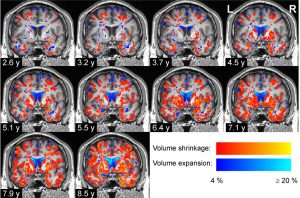
Vom Mandelkern bis in die Großhirnrinde
Tatsächlich zeigte sich ein spezifisches regionales Muster im Abbau der grauen Hirnsubstanz: Am schnellsten nahm das Volumen bei Arealen im Schläfenlappen, benachbarten Teilen des Scheitellappens und den unteren Teilen des Frontallappens ab. Schon relativ am Anfang manifestiert sich dabei der Abbau in der für die Emotionssteuerung wichtigen Amygdala und im enthorhinalen Cortex. Letzter ist eine entscheidende Schaltstelle zwischen dem für das Gedächtnis zuständigen Hippocampus und der Großhirnrinde.
Die Analysen enthüllten zudem Unterschiede zwischen Parkinson-Patienten mit noch weitgehend stabilen geistigen Leistungen und solchen mit deutlich zunehmendem geistigem Abbau. Bei Letzteren waren die hinteren Teile des Cortex und die motorischen Areale stärker und früher betroffen als bei den Patienten mit weniger schnell fortschreitenden Symptomen. Auch der Hippocampus, die Amygdala und die eng mit der fortgeschrittenen Verarbeitung von Reizen verknüpfte Inselrinde schrumpfte bei diesen Patienten früher.
Muster ähnelt der Ausbreitung fehlgefalteter Proteine
Dieses räumlich-zeitliche Muster des Hirnschwunds folgt damit einem ganz ähnlichen Verlauf wie die Ausbreitung der fehlgefalteten Alpha-Synucleine im Gehirn von Parkinson-Patienten. „Es gibt eine frappierende Übereinstimmung“, sagt Pieperhoff. Die meisten Teilnehmer durchlebten im Studienverlauf die Synuclein-Stadien drei bis fünf, wie die Forschenden erklären. Das Muster der Volumenabnahme bei der grauen Hirnsubstanz stimmte relativ gut mit diesen Phasen überein.
Interessant auch: Der Abbau der Hirnsubstanz folgte dabei insgesamt einem linearen Verlauf – es gab bei den einzelnen Patienten in den neun Jahren der Studie weder auffallende Phasen der Stagnation noch Zeiten besonders schnellen Abbaus. „Das deutet darauf hin, dass die jährliche Rate des Schwunds über die Beobachtungszeit hinweg nahezu konstant blieb“, berichten das Forschungsteam.
„Die Forschung zu Parkinson ist wie ein riesiges Puzzle, jede Studie liefert ein neues Teil“, erklärt Pieperhoff. Er und sein Team haben nun ein weiteres dieser Puzzleteile gefunden. „Hoffentlich können wir eines Tages die Teile zusammensetzen, um die Krankheit zu heilen oder ihr vorzubeugen“, so der Forscher weiter. (Cortex, 2022; doi: 10.1016/j.cortex.2022.03.009)
Quelle: Forschungszentrum Jülich