Im Takt der Gene: Forschende haben beobachtet, wie die Wirbelsäule im frühen Embryo angelegt wird – und welche Rolle dabei ein genetischer Taktgeber spielt. An einem aus Stammzellen gezüchteten Zellmodell konnte das Team erstmals dabei zusehen, wie nacheinander die einzelnen Wirbelvorläufer gebildet wurden. Ein neues Segment entstand dabei immer dann, wenn ein bestimmtes Uhren-Gen einen Zyklus seiner regelmäßigen Oszillationen absolvierte.
Die Wirbelsäule ist die tragende Säule unseres Körpers und wird entsprechend früh angelegt: Schon rund 20 Tage nach der Befruchtung beginnt beim menschlichen Embryo die Bildung der Wirbelsegment-Vorläufer, der Somiten. Diese paarigen Zellblöcke knospen dabei nacheinander aus dem Mesoderm, dem mittleren Keimblatt des Embryos. Die Reihenfolge und zeitlichen Abstände dieses Prozesses werden von der sogenannten Segmentationsuhr gesteuert, einem von Genen gesteuerten molekularen Oszillator, der die Bildung neuer Somitensegmente anstößt.
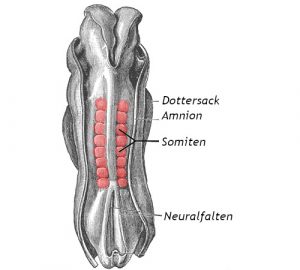
Von Stammzellen zu Wirbelvorläufern
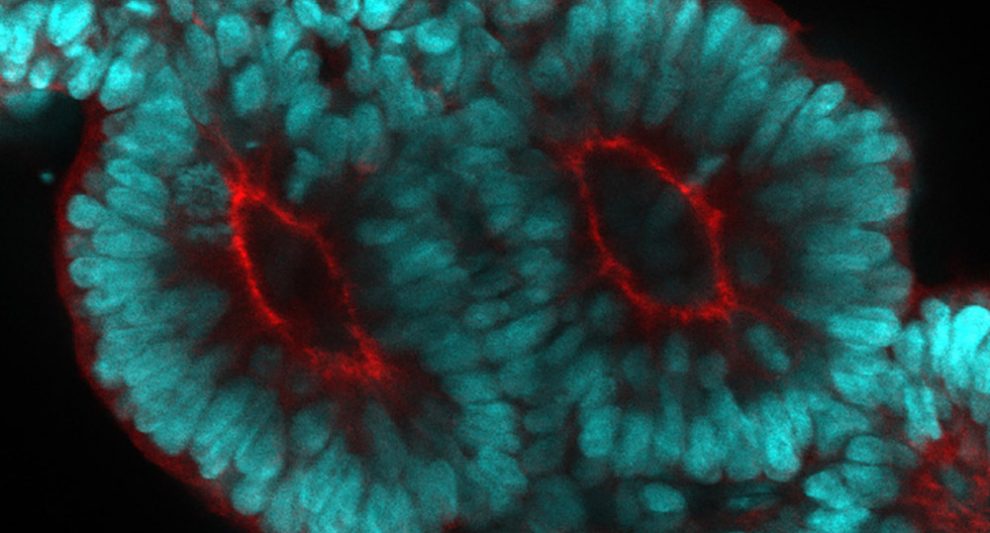
Wie die Somitenbildung genau abläuft und wann und wo die Segmentationsuhr eingreift, haben nun Marina Sanaki-Matsumiya vom European Molecular Biology Laboratory (EMBL) in Barcelona und ihre Kollegen erstmals an einem dreidimensionalen Zellmodell nachvollzogen. Ausgangsbasis waren menschliche pluripotente Stammzellen, die aus adulten Zellen erzeugt worden waren. Durch Zugabe eines speziellen Cocktails von Wachstumsfaktoren und anderen Botenstoffen lösten die Wissenschaftler die Differenzierung dieser Stammzellklumpen aus.
Sehr früh zeigten sich erste Anzeichen der Somitenbildung: Nach drei Tagen war bereits zu erkennen, dass sich die ersten Zellen verlängerten und in einer Achse ausrichteten. Nach Zugabe eines weiteren, proteinreichen Nährstoffzusatzes entwickelten sich die ersten voll ausgebildeten Somiten: „Bis zum siebten Tag hatten alle 210 Ansätze mindestens drei Somiten gebildet, im Schnitt waren es sieben“, berichtet das Team.
Autonom und mit fester Größe
Die Somiten entstanden dabei wie im Embryo nacheinander – erst am Vorderende des embryoartigen Zellklumpens, dann sukzessive weiter Richtung Hinterende. Unabhängig von der anfänglich vorhandenen Zahl der Stammzellen hatten alle Somiten dabei die gleiche Größe. „Dies deutet darauf hin, dass die Somiten eine bevorzugte, artspezifische Größe haben, die durch lokale Zellinteraktionen, die Segmentationsuhr oder andere Mechanismen gesteuert wird“, erklärt Sanaki-Matsumiya.
Und noch etwas demonstrierte die Bildung dieser zellulären Wirbelvorläufer im Laborexperiment: Die Somitogenese ist offensichtlich ein autonomer Prozess, der unabhängig von angrenzenden Geweben oder einer übergeordneten Steuerung abläuft. Die Zellen selbst, ihre Interaktionen und Gene stoßen die Prozesse an, die zur Bildung der anfangs noch rund 40 Somiten im Embryo führen, wie die Forschenden feststellten.
Oszillierendes Gen als Taktgeber
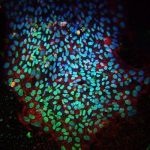
Um die Rolle der genetischem Taktgeber bei diesem Prozess aufzuklären, versahen Sanaki-Matsumiya und ihre Kollegen das zentrale Gen der Segmentationsuhr, HES7, mit einem Fluoreszenzmarker. Sie konnten so direkt beobachten, wann dieses Gen aktiv wurde und wie stark. Frühere Studien hatten bereits nahelegt, dass das Uhrengen in einem regelmäßigen Takt oszilliert und dass dies das Timing der Somitenbildung beeinflusst.
Tatsächlich konnte das Team beobachten, dass das HES7-Gen nach rund zwei Tagen aktiv wurde und regelmäßige Aktivitätszyklen zeigte. Diese Wellen erhöhter Genaktivität pflanzten sich dabei von den jeweils neuesten, frisch gebildeten hinteren Somiten nach vorne fort. „Das Timing der HES7-Oszillationen stimmte dabei mit dem der Somitenbildung überein: In jedem Oszillationszyklus wurde ein Somit oder ein Somitenpaar gebildet“, berichten die Wissenschaftler.
Plattform für weitere Forschung
Damit bestätigt das dreidimensionale In-Vitro-Modell die bisherigen Annahmen zur Entstehung der Wirbelvorläufer, eröffnet aber auch neue Möglichkeiten, die Bildung dieser für unseren Körper essenziellen Strukturen näher zu erforschen. „Diese Zellmodelle bieten uns auch eine neue Plattform, um erblich bedingte Fehlbildungen in der Segmentation der Wirbelsäule zu untersuchen, darunter auch die erbliche Skoliose“, schreiben Sanaki-Matsumiya und ihre Kollegen.
Das Team um Sanaki-Matsumiya plant aber auch, auf Basis ihrer Methode vergleichende Untersuchungen bei verschiedenen Tierarten durchzuführen. Dafür haben sie bereits damit begonnen, Stammzellen aus Zellproben von Kaninchen, Rindern und Nashörnern zu züchten. (Nature Communications, 2022; doi: 10.1038/s41467-022-29967-1)
Quelle: European Molecular Biology Laboratory