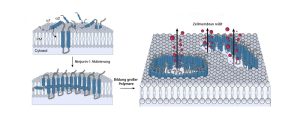
Reißverschluss statt Ballon: Viele unserer Zellen töten sich selbst, um zum Beispiel die Ausbreitung einer Infektion zu verhindern. Anders als lange Zeit angenommen platzen sie allerdings nicht einfach wie ein Ballon. Stattdessen fügen sich spezielle Membranproteine zu einer Kette zusammen, entlang derer sich die Zellmembran dann wie ein Reißverschluss öffnet und schließlich zum Tod der Zelle führt. Diese neuen Erkenntnisse könnten zukünftig die Therapie von Krebs oder Parkinson optimieren, so die Wissenschaftler.
In unserem Körper sterben jeden Tag Millionen von Zellen, indem sie sich selbst töten. Eine Zelle begeht dann Selbstmord, wenn sie beschädigt oder mit Viren und Bakterien infiziert ist. Der programmierte Zelltod, auch Apoptose genannt, soll dann verhindern, dass die Zelle entartet und Tumore entstehen oder dass sich Erreger in ihr weiter vermehren und im Körper ausbreiten.
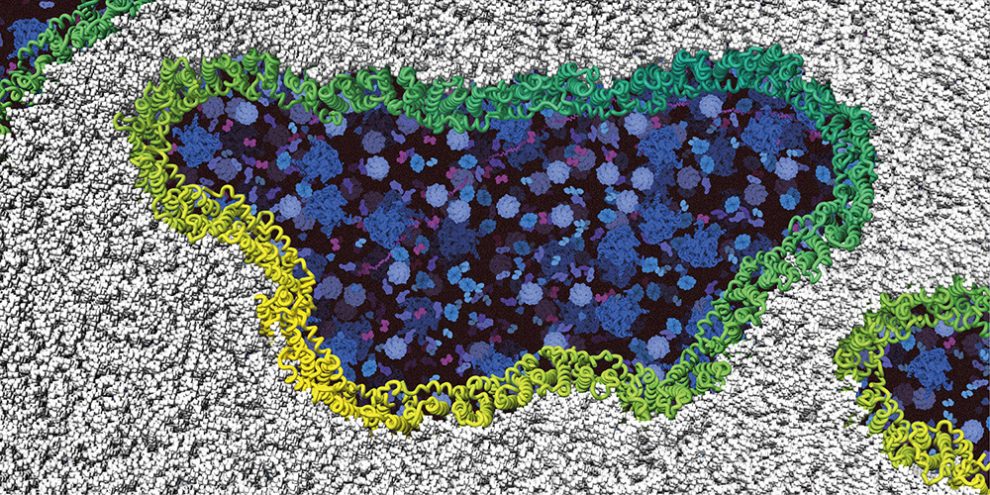
Lange Zeit ging die Wissenschaft davon aus, dass sich am Ende dieses Sterbeprozesses Löcher in der Zellmembran bilden, durch die Flüssigkeit ins Zellinnere strömt. Dadurch würde die Zelle dann langsam aufquellen und aufgrund des Überdrucks schließlich wie ein Ballon platzen – so die Annahme. Doch ein US-Forschungsteam hat diese These kürzlich widerlegt. Wie sieht das Selbstmordprogramm einer Zelle also stattdessen aus?
Atomgenauer Einblick in den Zelltod
Forschende um Morris Degen von der Universität Basel haben nun untersucht, was wirklich mit einer Zelle passiert, die sich selbst umbringt. Dafür kombinierten sie hochauflösende bildgebende Verfahren wie die Super-Resolution-Mikroskopie mit biochemischen Ansätzen und Kernspinresonanzspektroskopie. Durch diesen Methodenmix konnten sie die Apoptose schließlich auf atomarer Ebene beobachten und somit die genauen Mechanismen aufklären, die ihr zugrunde liegen.