Wo im Gehirn Alzheimer zuerst Hirnzellen absterben lässt, ist nicht bei allen Betroffenen gleich. Bei vielen beginnt der Abbau im Gedächtniszentrum, bei anderen treten als erstes Seh- und Sprachstörungen auf. Warum, könnte jetzt ein Forschungsteam aufgeklärt haben. Demnach spielt die lokal unterschiedliche Aktivität von Risiko-Genvarianten wie APOE-4 im Gehirn eine entscheidende Rolle dafür, wo sich zuerst die schädlichen Klumpen der Amyloid- und Tau-Proteine bilden.
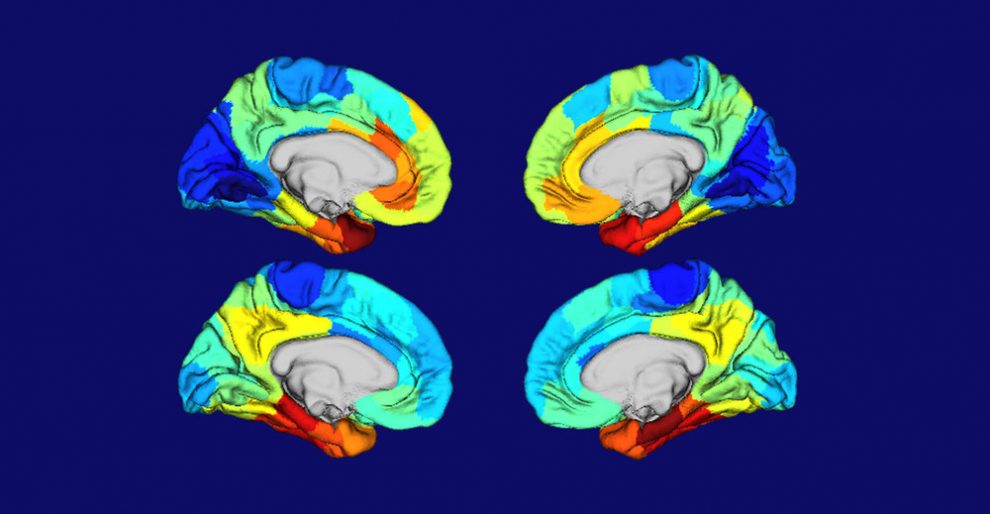
Noch bevor die ersten Symptome der Alzheimer-Demenz erkennbar sind, reichern sich im Gehirn der Betroffenen schon fehlgefaltete Amyloid-Beta- und Tau-Proteine an. Sie gelten als Auslöser für den Niedergang der Hirnzellen und die fortschreitenden geistigen Ausfälle. Typischerweise werden die für das Gedächtnis wichtigen Hirnareale im Schläfenlappen und angrenzenden Hirnbereichen als erste geschädigt, deshalb manifestiert sich Alzheimer meist zuerst durch Vergesslichkeit und Orientierungsprobleme.
Doch das ist nicht immer so: „Es gibt einige atypische Alzheimerfälle, in denen die Patienten erst Sprach- oder Sehstörungen entwickeln statt Gedächtnisprobleme“, erklärt Seniorautor Brian Gordon von der Washington University in Saint Louis. „Wenn man ihr Gehirn anschaut, sieht man Schäden in den Sprach- und Sehzentren, aber kaum in den Gedächtniszentren.“ Inzwischen lassen sich je nach Symptomatik und Ausbreitungsmuster der schädlichen Tau-Fibrillen vier Subtypen von Alzheimer unterscheiden.
Risikogene im Visier
Aber warum? Auf der Suche nach einem Faktor, der diese Unterschiede im Verlauf und den betroffenen Hirnregionen bestimmt, haben Gordon, seine Kollegin Aylin Dincer und ihr Team sich den wichtigsten genetischen Risikofaktor für Alzheimer näher angeschaut: Apolipoprotein-4 (APOE-4). Diese Variante eines eigentlich für die Regulation von Blutfettwerten zuständigen Gens fördert die Ablagerung von Amyloid-Plaques und kann das Risiko für Alzheimer um das bis zu Zwölffache erhöhen.