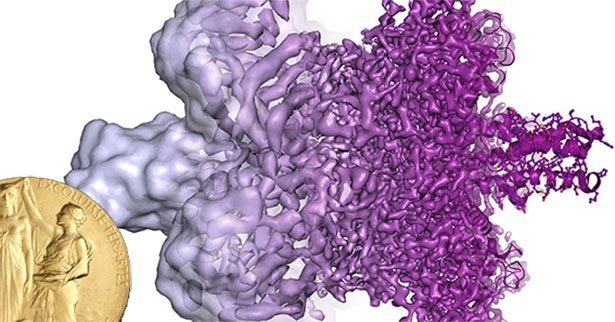
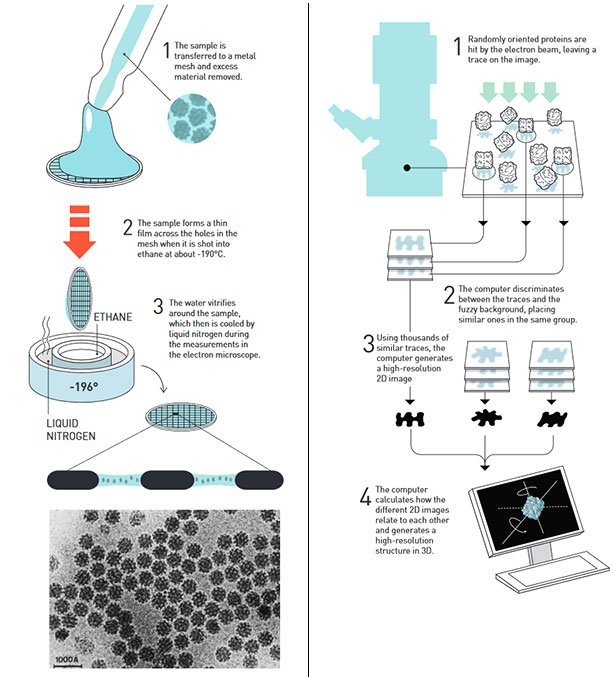
Einblicke in die Moleküle des Lebens: Den diesjährigen Chemie-Nobelpreis bekommen Jacques Dubochet, Joachim Frank und Richard Henderson – drei Forscher, die die Cryo-Elektronenmikroskopie entwickelt haben. Dieses Verfahren hat es ermöglicht, Biomoleküle in Aktion zu sehen und atomgenau abzubilden. Ihm verdanken wir so spektakuläre Aufnahmen wie von Bakterien beim Angriff auf Zellen, von Fotosynthese-Molekülen beim Lichtfang oder der Struktur des Zika-Virus.
Lange Zeit waren Biomoleküle wie Proteine, die DNA oder RNA die großen Unbekannten der Biochemie. Zwar konnten Wissenschaftler mithilfe der Röntgen-Kristallografie auf die Struktur dieser Moleküle schließen, doch diese Aufnahmen zeigen die Biomoleküle nur in kristallisierter, erstarrter Form. Wie sich diese komplexen Verbindungen bewegen und wie sie miteinander interagieren, blieb weitgehend unbekannt. Viele Biomoleküle lassen sich zudem nicht kristallisieren und entzogen sich daher komplett unserer Sicht.
Auch die Elektronenmikroskopie eignet sich nur bedingt zur Abbildung solcher Biomoleküle. Denn damit die Strahlen reflektiert werden und so dessen Struktur und Form verraten, muss die Probe aufwändig präpariert, getrocknet und beispielsweise mit Schwermetall-Salzen bedampft werden. Diese Behandlung jedoch verändert viele Biomoleküle und kann sie sogar zerstören.
Richard Henderson: Zucker und schwache Strahlung
Mit dieser Situation wollte sich der Brite Richard Henderson nicht zufriedengeben. In seinem Labor in Cambridge arbeitete er an einer Methode, mit der er das Fotosynthese-Protein Bacteriorhodopsin sichtbar machen konnte. Seine Idee: Er ersetzte das Wasser in der Proteinlösung mit einer Glucoselösung, die das Molekül im Vakuum des Elektronenmikroskops stabilisierte.