Rausschneiden und ersetzen
Anfang der 1970er Jahre stellte Tomas Lindahl während seiner Arbeit am Karolinska Institut in Stockholm fest, dass die DNA keineswegs völlig stabil und unveränderlich ist, wie noch Ende der 1960er Jahre angenommen. Stattdessen ist auch das Erbmolekül anfällig für Schäden und Zerfallsprozesse – und das in einer ziemlich hohen Rate. Warum aber blieb die DNA in unseren Zellen trotzdem über Jahrzehnte stabil?
Lindahl vermutete, dass es in den Zellen Enzyme geben muss, die die entstehenden Schäden wieder reparieren. In Experimenten machte er tatsächlich eines dieser Enzyme ausfindig: Er entdeckte ein bakterielles Protein, das immer dann aktiv wird, wenn die Base Cytosin eine Aminogruppe verliert und damit den Code verändert. Es schneidet die halbkaputte Base aus dem Doppelstrang heraus, so dass die komplementäre Base erhalten bleibt und ihr Gegenpart neu ergänzt werden kann.
1974 veröffentlichte Lindahl dieses erste Beispiel für den Mechanismus der sogenannten Basen Exzisions-Reparatur. In den folgenden gut 20 Jahren entdeckte er weitere Beispiele dafür und schaffte es 1996 sogar, diesen DNA-Reparaturprozess im Reagenzglas nachzubauen.
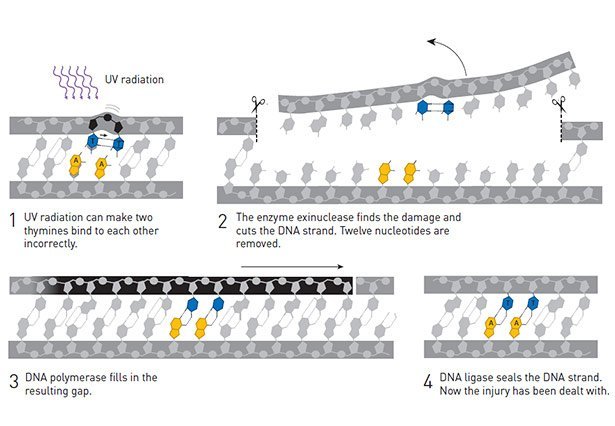
Bei DNA-Schäden durch UV-Licht schneiden Enzyme die beschädigten Stellen heraus und führen Reparaturen vor Ort durch. © nobelprize.org
Hilfe gegen UV-Schäden
Doch es gibt Schäden an der DNA, die mit diesem Mechanismus nicht behoben werden können, dazu gehören auch die Zerstörungen, die die UV-Strahlung an unserem Erbmaterial anrichtet. Wie diese behoben werden, hat der türkische Forscher Aziz Sancar entschlüsselt. Ihm war Anfang der 1970er Jahre bei Bakterien etwas Seltsames aufgefallen: Wenn er diese mit tödlichen UV-Strahlen beschoss, erholten sie sich wieder, sobald sie blauem Licht ausgesetzt waren.
Während seiner Zeit an der Yale University in den USA kam Sancar diesem seltsamen Reparatur-Mechanismus auf die Schliche: wie sich zeigte, besitzen die Bakterienzellen ein Enzym, die Photolyase, die unter Lichteinfluss die UV-Schäden an der DNA ausbessern können. Wenig später stieß Sancar bei seinen Arbeiten auf eine zweite Gruppe von Enzymen, die solche Schäden auch im Dunkeln beheben.
Für diese Nukleotid-Exzisions-Reparatur schneiden die Enzyme links und rechts vom UV-Schaden einen Strang der DNA durch und entfernen das rund ein Dutzend Basenpaare lange Stück. Anschließend füllt die DNA-Polymerase die Lücke wieder auf, indem sie die jeweils komplementären Basen zum erhalten gebliebenen zweiten Strang einbaut. 1983 veröffentlichte Sancar diesen Reparatur-Mechanismus, der auch in unseren Zellen so abläuft.
Ein Enzym gegen Fehlkopien
Der dritte Nobelpreisträger, der US-Amerikaner Paul Modrich, entschlüsselte einen entscheidenden Kontrollmechanismus, der dafür sorgt, dass die DNA korrekt kopiert wird. Gemeinsam mit einem Kollegen erzeugte er mit Hilfe eines Virus absichtlich einen fehlerhaften DNA-Doppelstrang: Einige Basenpaare eines Strangs waren ausgetauscht. Doch als die Forscher diese DNA in eine Bakterienzelle injizierten, reparierte die Zelle die Fehler: Sie kopierte nur den korrekten Strang und ließ den fehlerhaften links liegen.
Wie sich zeigte, ist für diese „Mismatch-Reparatur“ das Enzym Dam Methylase entscheidend. Denn diese lagert Methylgruppen an den intakten Strang an und markiert ihn dadurch als korrekt. Dadurch verringern sich Fehler beim Kopieren der DNA um das Tausendfache. Woher allerdings dieses Enzym immer genau weiß, welchen Strang es markieren muss, ist bis heute nicht eindeutig aufgeklärt.
Zusammen haben die drei Nobelpreisträger fundamentale Informationen darüber geliefert, wie unsere Zellen Schäden am Erbmolekül DNA beheben und wie ihr Werkzeugkasten dabei aussieht. Da DNA-Schäden unter anderem Krebs verursachen können, bilden ihre Erkenntnisse eine wichtige Basis für viele medizinische und biochemische Anwendungen.
(nobelprize.org, 07.10.2015 – NPO)
7. Oktober 2015