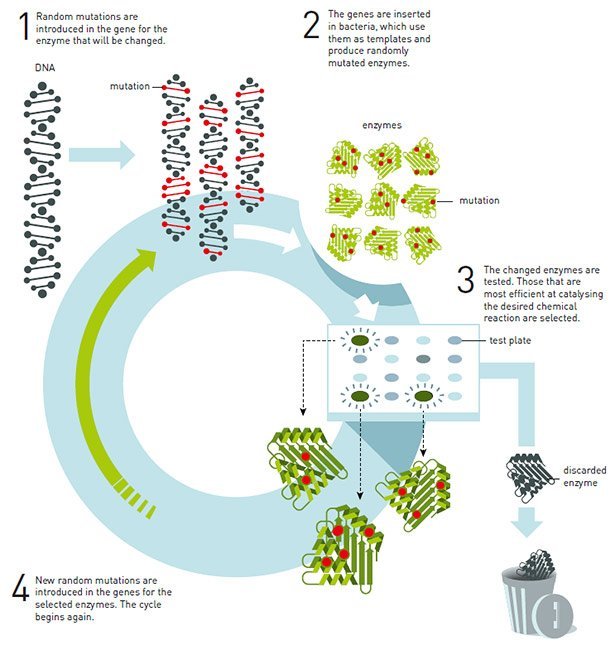
Das Prinzip der gelenkten Evolution zur Enzymproduktion © Johan Jarnestad/ The Royal Swedish Academy of Sciences
Gezielt ein Enzym von Grund auf so zu konstruieren, dass es die gewünschte chemische Reaktion vermittelt, ist mit rein chemischen Methoden daher extrem aufwändig und langwierig. Das erkannte auch Arnold und wählte einen neuen Ansatz: Sie versuchte nicht, ein bestehendes Enzym chemisch für ihre Zwecke anzupassen, sondern veränderte dessen biologischen Bauplan – die DNA.
Dafür löste sie zufällige Mutationen im Gencode für das Enzym Subtilisin aus, das unter anderem das Milcheiweiß Casein zerlegen kann. Ihr Ziel: Eine Variante dieses Enzyms zu schaffen, das diese Fähigkeit nicht nur in wässrigen Lösungen besitzt, sondern auch in einem organischen Lösungsmittel. Dafür schleuste Arnold die zufällig veränderten DNA-Baupläne in Bakterienzellen ein und ließ diese die Enzymvarianten produzieren. Dann testete Arnold, welche der veränderten Enzyme am effektivsten die von ihr gewünschte Reaktion katalysierten und setzte ihre „Zucht“ gezielt mit diesen DNA-Varianten fort. Mit Erfolg: Sie identifizierte zehn Mutationen im Bauplan des Subtilisins, die dem Enzym die gewünschte Eigenschaft verliehen.
Seither ist die von Arnold entwickelte Methode der DNA-basierten, gelenkten Evolution neuer Enzymvarianten zu einer der Standardmethoden der Biochemie geworden. Heute werden damit unter anderem Enzyme für die Arzneimittelproduktion, für die chemische Industrie und auch für die Herstellung von Biokraftstoffen produziert. Viele zuvor nur durch giftige oder teure Reagenzien erreichbaren chemischen Reaktionsschritte lassen sich dadurch heute durch Enzyme und damit umweltfreundlicher und nach dem Vorbild der Natur durchführen.
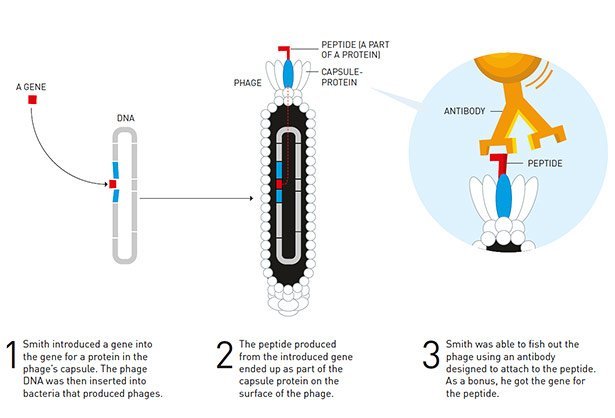
Das Prinzip des Phagen-Display © Johan Jarnestad/ The Royal Swedish Academy of Sciences
Smith: Phagen als „Bauplan“-Finder
Auch George P. Smith und Sir Gregory P. Winter, die sich die zweite Hälfte des diesjährigen Chemie-Nobelpreises teilen, nutzten das Prinzip der gelenkten Evolution für die Entwicklung neuer Biomoleküle. Den ersten Schritt machte der US-Forscher Smith in den 1980er Jahren. Er forschte an Phagen, virenartigen Gebilden, die Bakterien infizieren. Phagen bestehen aus nicht viel mehr als einer Hülle und einem Genom, das sie bei Kontakt mit einem Bakterium in dieses injizieren.
Dieses einfache Prinzip brachte Smith auf die Idee, Phagen als Helfer bei der Suche nach den genetischen Bauplänen für bekannte Proteine einzusetzen. Dafür kombinierte er Genfragmente mit unbekanntem Inhalt mit einem Gen, das für ein Hüllprotein des Phagen kodierte. Der Phage bildete daraufhin ein Hüllprotein, das auch Teile des vom unbekannten Genschnipsel kodierten Proteins enthielt.
Nun folgte der entscheidende Schritt: Smith gab der Phagenlösung Antikörper hinzu, die nur an das Protein banden, dessen Bauplan man suchte. Die Antikörper markiertem ihm damit den Phagen, der das Proteinstück und damit auch den Genschnipsel mit dessen Bauplan trug.
Winter: Antikörpersuche mit Phagenhilfe
Diese Phagen-Display-Methode führte kurz darauf der Brite Gregory Winter einen Schritt weiter. Er erkannte, dass man durch die Phagen als Bindeglied zwischen Protein und genetischem Bauplan auch gezielt Antikörper für medizinische Zwecke finden und über ihren DNA-Code biotechnologisch produzieren kann. Dafür nutzte Winter die von Smith entwickelte Methode und stellte zunächst eine ganze Bibliothek von Phagen her, die jeweils verschiedene Antikörper auf ihrer Hülle tragen.
Wird nun für ein bestimmtes Protein, beispielsweise einen Rezeptor auf der Oberfläche von Krebszellen, ein Antikörper gesucht, kommt die Phagen-Bibliothek zum Einsatz: Winter testete, welche Phagen dank ihrer Hüllen-Antikörper am besten auf den Rezeptor reagierten. Den Antikörper-Bauplan, den diese Phagen trugen, optimierte der Forscher dann durch DNA-Veränderung und erneutes Einschleusen in Phagen, bis die von ihnen produzierten Antikörper so effektiv wie gewünscht an den Krebszell-Rezeptor binden.
Mithilfe dieser Methode lassen sich heute gezielt Antikörper-Therapien für bestimmte Krankheiten entwickeln. Winter und sein Team produzierten damit in den 1990er Jahren das erste Arzneimittel, das komplett auf einem Antikörper basierte: Das Präparat Adalimumab wurde 2002 als Mittel gegen rheumatoide Arthritis zugelassen und wird heute auch gegen chronische Darmentzündungen eingesetzt. Seither wurden mit der von Smith und Winter entwickelten Methode weitere Antikörper-Medikamente unter anderem gegen metastasierenden Krebs, Autoimmmun-Erkankungen und Toxine entwickelt.
(Nobel Foundation, 04.10.2018 – NPO)
4. Oktober 2018