Chemiker haben neue Einblicke in eines der größten Mysterien des Wassers gewonnen: seine Eigendissoziation. Dieser spontane Zerfall von Wassermolekülen in Ionen macht das Wasser zu einem so guten Lösungsmittel. Doch wie dieser Zerfall im Einzelnen abläuft und unter welchen Bedingungen, war bisher nur in groben Zügen bekannt. Jetzt haben Forscher die Eigendissoziation erstmals im Computer nachvollzogen und modelliert, wie sie im Fachmagazin „Scientific Reports“ berichten.
Wasser ist in gleich mehrerer Hinsicht eine ungewöhnliche Substanz: Es bildet beim Gefrieren je nach Druck und Temperatur gut ein Dutzend verschiedener Eisformen, kann aber andererseits sogar bei gut 40 Grad unter Null flüssig bleiben. Die Wechselwirkungen der Wassermoleküle untereinander verursachen zudem für die Dichteanomalie und machen Wasser zu einer Flüssigkeit mit zwei verschiedenen Strukturvarianten.
Spontaner Zerfall
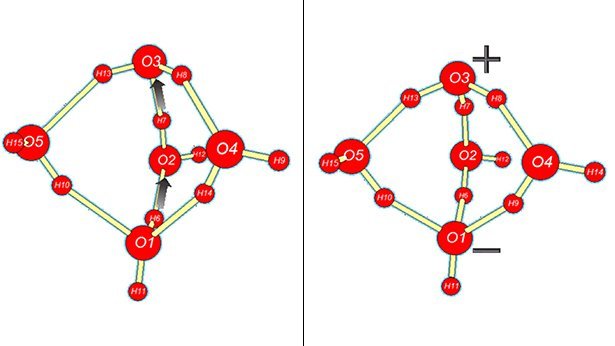
Jetzt haben Eva Perlt von der Universität Bonn und ihre Kollegen ein weiteres Geheimnis des Wassers gelüftet: die sogenannte Eigendissoziation. Eigentlich sind die Bindungskräfte innerhalb des Wassermoleküls so stark, dass sein spontaner Zerfall extrem unwahrscheinlich ist. Dennoch zeigen Messungen, dass selbst reines Wasser eine geringe Leitfähigkeit besitzt.
Das aber ist nur dann zu erklären, wenn zumindest ein kleiner Teil der Wassermoleküle zerfällt: in ein negativ geladenes Hydroxid-Ion (OH–) sowie ein positiv geladenes Hydronium-Ion (H3O+). „Diese Eigendissoziation bildet die Grundlage für viele Säure-Base-Reaktionen – also für alles, was mit dem pH-Wert zusammen hängt“, erklärt Perlt. Ohne diese zentrale Eigenschaft wäre Leben, wie wir es kennen, wohl auf der Erde nicht denkbar.