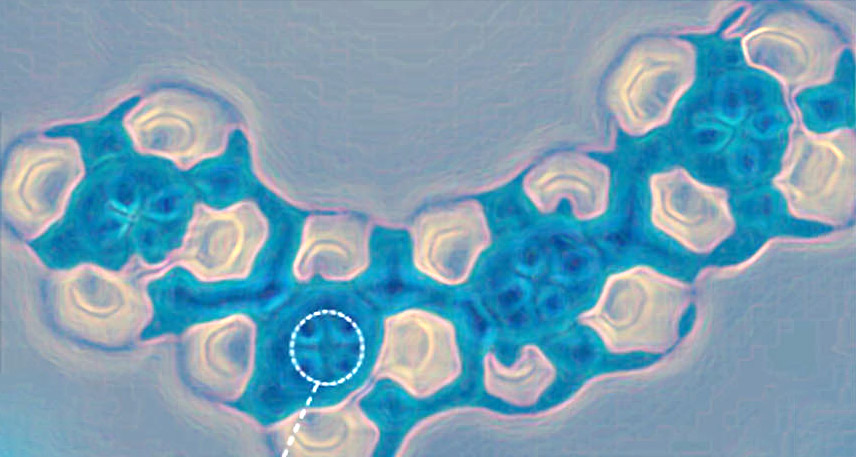
Blick ins Atom: Chemikern ist es gelungen, die Elektronenorbitale von einzelnen Eisen- und Cobalt-Atomen sichtbar zu machen. Die Aufnahmen mittels Rasterkraftmikroskop und computergestützter Pico-Spektroskopie enthüllen die subtilen Unterschiede zwischen den im Periodensystem nebeneinander liegenden Metallen. Der Blick auf Elektronenorbitale einzelner Atome eröffnet die Chance für neue Einblicke in chemische Bindungen und Reaktionen, wie das Team in „Nature Communications“ berichtet.
Für das Verhalten der Atome in chemischen Reaktionen sind in erster Linie ihre Elektronen verantwortlich. Sie bewegen sich je nach Anzahl und Energiezustand in verschiedenen Orbitalen um den Atomkern. Als Elektronenorbital wird dabei der Raum zusammengefasst, in dem die größte Aufenthaltswahrscheinlichkeit für das betreffende Elektron besteht. Ihre Form und Menge bestimmt die Art der chemischen Bindung und auch die Eigenschaften des entstehenden Moleküls.
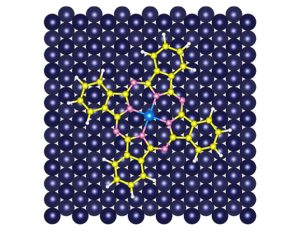
Eisen- und Cobaltatome im Vergleich
Doch wie die Elektronenorbitale eines Atoms tatsächlich aussehen, lässt sich meist nur über theoretische Berechnungen ermitteln, unter anderem auf Basis der Bindungsenergien, der Atomabstände und des Reaktionsverhaltens. „Die direkte Messung der elektronischen Struktur eines Einzelatoms oder einer chemischen Bindung ist dagegen schwierig“, erklären Pengcheng Chen von der Princeton University und seine Kollegen.
Trotzdem ist es dem Team nun gelungen, erstmals die Elektronenorbitale von Eisen- und Cobaltatomen abzubilden und zu vergleichen. In ihrem Experiment diente das Stickstoff-Kohlenstoff-Ringmolekül Phtalocyanin als „Träger“ für diese Atome. In seinem Zentrum war entweder ein Eisen- oder ein Cobaltatom gebunden. Die auf einer Kupferoberfläche angeordneten Komplexverbindungen tasteten die Chemiker dann mit einem hochauflösenden Nichtkontakt-Rasterkraftmikroskop ab (HR-AFM).
Helle Lappen und kompaktes Quadrat
Die Aufnahmen zeigten: „Das Cobaltatom erscheint heller und mit vier deutlich erkennbaren Lappen in der horizontalen Ebene, während das Eisenatom eine fast quadratische Form zu haben schien“, berichten Chen und seine Kollegen. Parallel zu diesen sichtbaren Formunterschieden zeigten beide Atome auch winzige Unterschiede in der Kraft, die sie auf die Mikroskopspitze ausübten: Die sogenannte Pico-Spektroskopie ergab für Cobalt eine um rund fünf Piconewton stärkere Abstoßungskraft als bei Eisen.
„Als wir diese Aufnahmen und Werte sahen, waren wir erstaunt, dass ein Experiment überhaupt so geringe Unterschiede einfangen kann“, sagt Koautor James Chelikowsky von der University of Texas in Austin. Die Messungen zeigten sogar, dass die über diese Kraft erfasste Energielandschaft rund um das Eisenatom relativ flach war. Beim Cobaltatom hingegen waren auffällige Höhen und Senken erkennbar. Der Verdacht lag nahe, dass subtile Unterschiede in den Elektronenorbitalen der beiden Elemente dafür verantwortlich waren.
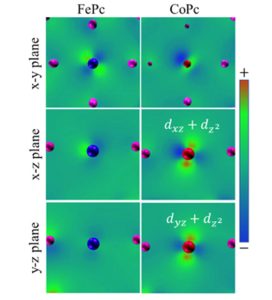
Eisen hat flache, Cobalt hochstehende 3d-Orbitale
Um dies zu erhärten, überprüften die Forschenden ihre Daten mithilfe der sogenannten Dichtefunktionaltheorie (DFT). Sie ermöglicht es, auf Basis grundlegender quantenphysikalischer Gesetzmäßigkeiten die zu erwartenden Elektronendichten und Orbitalkonfigurationen für Atome und Moleküle zu ermitteln. „Wir haben dafür mit hunderten verschiedener Computerberechnungen die Quantenkraft an jedem einzelnen Rasterpunkt der Probe berechnet“, berichtet Koautor Dingxin Fan von der Princeton University.
Die Ergebnisse dieser Überprüfung bestätigten die Vermutung: „Die beobachteten Unterschiede gehen auf Differenzen in den hochangeregten 3d-Elektronen von Eisen und Kupfer zurück“, erklärt Fan. Demnach nehmen die Elektronen im angeregten Eisenatom vornehmlich die in einer Ebene liegenden dxy– und dx2-y2-Orbitale ein – dies erzeugt die flache, fast quadratische Form. Beim Cobalt sind dagegen primär die nach oben und unten aus der Ebene herausstehenden dxz– und dz2-Orbitale besetzt.
Neue Möglichkeiten für Chemie, Nanotechnologie und Materialforschung
Damit hat das Forschungsteam demonstriert, dass ihre Rasterkraftaufnahmen tatsächlich die Elektronenorbitale einzelner Eisen- und Cobaltatome abbilden und deren Unterschiede widerspiegeln. Dies eröffne neue Möglichkeiten für die Erforschung von Atomen und Molekülen: „Indem wir die Signaturen der Elektronenorbitale mit Techniken wie der Rasterkraftmikroskopie direkt beobachten, können wir das Verhalten einzelner Atome und Moleküle besser verstehen“, sagt Chelikowsky.
„Dies ist besonders wichtig in Forschungsfeldern wie der Materialforschung, der Nanotechnologie und der Katalyse“, so der Chemiker weiter. Denn die direkte Beobachtung der Elektronenorbitale kann beispielsweise verraten, wo in einem Molekül die für chemische Reaktionen oder die Katalyse wichtigen Veränderungen stattfinden. Zudem könnte dies helfen, neue, maßgeschneiderte Materialien zu entwickeln. (Nature Communications, 2023; doi: 10.1038/s41467-023-37023-9)
Quelle: University of Texas at Austin