Die Korrosion wichtiger Legierungen wie Edelstahl verursacht jedes Jahr weltweit riesige wirtschaftliche Schäden. Dennoch sind die grundlegenden mikroskopischen Vorgänge dieses Alltagsphänomens noch weitgehend unverstanden. Ein europäisches Forscherteam hat jetzt erstmals die atomaren Prozesse bei der Korrosion einer Legierung „live“ verfolgt.
Zur großen Überraschung der Wissenschaftler um Andreas Stierle vom Max-Planck-Institut für Metallforschung sowie Kollegen der Universität Ulm sowie des Europäischen Synchrotronstrahlungsquelle (ESRF) in Grenoble/Frankreich, entsteht bei der an sich zerstörerischen Korrosion zunächst eine perfekte kristalline Schutzschicht, deren Struktur und chemische Zusammensetzung die Wissenschaftler mit Hilfe hochbrillianter Synchrotronstrahlung entschlüsseln konnten. Ihre Beobachtungen über die sie in der aktuellen Ausgabe des Wissenschaftsmagazin Nature berichten, zeigen zudem, wie man technologisch relevante Legierungsoberflächen durch gezielte Korrosionsprozesse nanostrukturieren kann.
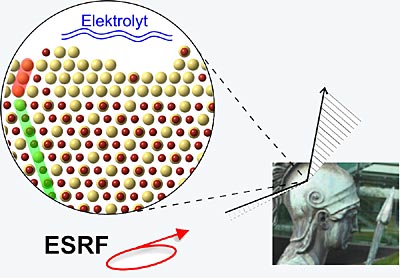
Für ihre grundlegenden Untersuchungen haben die Forscher des Max-Planck-Instituts für Metallforschung und der Europäischen Synchrotronstrahlungsquelle mit Cu3Au eine Legierung ausgewählt, deren zwei Komponenten ein stark unterschiedliches Korrosionsverhalten aufweisen. Während Kupfer schon bei kleinen Korrosionspotenzialen, also einer elektrischen Spannung, die man zwischen der Probe und einer Referenzelektrode durch den Elektrolyten anlegt, in eine schwelfelsäurehaltige Lösung übergeht, ist Gold weitaus widerstandsfähiger.
Gold und Kupfer als Testkandidaten
Mit Hilfe der brillianten Synchrotronstrahlung haben die Forscher nun das Einsetzen der Korrosion bei der Legierung Cu3Au in hoher Auflösung und zerstörungsfrei untersucht. Dabei gelang es ihnen erstmalig, die Grenzfläche zwischen dem flüssigen Elektrolyten und dem Legierungskristall mit einer Auflösung im Picometer-Bereich (1 Nanometer = 1.000 Picometer) direkt während des Korrosionsprozesses zu analysieren.
Wird nur wenig Kupfer aus dieser Grenzfläche herausgelöst, verändert sich diese und es bildet sich eine einkristalline, nur drei atomare Lagen dicke, goldreiche Passivierungsschicht, die die Oberfläche des Materials zunächst vor weiterer Korrosion schützt. Dabei übernimmt diese Passivierungsschicht interessanterweise die Kristallstruktur des Substrats nicht eins zu eins. Vielmehr wirkt die Grenzfläche des Materials zum Elektrolyten wie ein Spiegel, der bewirkt, dass der Film mit der Zwillingsstruktur des Substrats aufwächst.
Kontrollierte Korrosion
Erhöht man nun das Korrosionspotenzial weiter durch Änderung der elektrischen Spannung zwischen Probe und Referenzelektrode, so wird auch das restliche Kupfer aus der zunächst schützenden Passierungsschicht herausgelöst und die verbleibenden Goldatome bilden etwa zwei Nanometer hohe Goldinseln, die die Oberfläche nicht mehr komplett bedecken. Dieser Vorgang, auch Entnetzung genannt, ist bereits aus der Natur bekannt, wenn sich etwa Regentropfen auf einem Blatt zusammenziehen. Die Korrosion schreitet nun über die direkt mit dem Elektrolyten in Kontakt stehenden Cu3Au-Flächen fort und es bildet sich eine löchrige, schaumartige Struktur mit Korrosionsporen.
Aus diesen Forschungsergebnissen können Materialwissenschaftler lernen, dass man eine optimale Oberflächenpassivierung von Legierungen erhält, wenn man das Korrosionspotential über der Oberfläche gezielt so einstellt, dass sich eine Passivierungsschicht bildet. Darüber hinaus ist die kontrollierte Korrosion bei höheren Potentialen eine elegante Methode, mit der man Materialoberflächen chemisch im Nanometer-Bereich strukturieren kann. Schreitet die Korrosion immer weiter voran, bildet sich schließlich ein nanoporöser Goldfilm, der auf Grund seiner sehr großen Oberfläche etwa als Katalysatormaterial genutzt werden kann.
(MPG, 09.02.2006 – DLO)