Eine neue Triebkraft chemischer Reaktionen hat jetzt ein internationales Chemiker-Team entdeckt: Die Wissenschaftler konnten zeigen, dass die sogenannte Tunnelkontrolle chemische Reaktionen in eine Richtung lenken kann, die weder durch das etablierte Prinzip der kinetischen Kontrolle – in Richtung der Reaktion mit der geringsten Barriere – noch durch das der thermodynamischen Kontrolle (in Richtung der energetisch günstigsten Reaktion) vorhergesagt worden wäre.
Die Ergebnisse der neuen Studie im Wissenschaftsmagazin „Science“ könnten starken Einfluss darauf haben, wie Wissenschaftler chemische Umsetzungen verstehen und entwerfen – sei es in der Chemie, den Materialwissenschaften oder der Biochemie.
Chemische Reaktionen sind wie Bergwanderungen
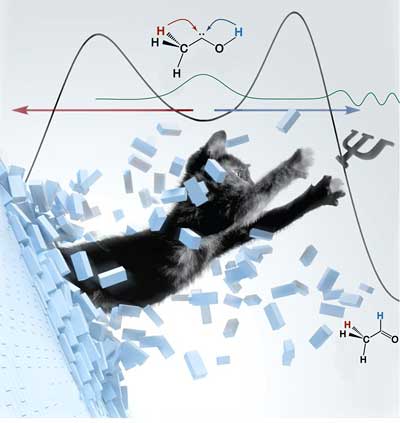
Chemische Reaktionen kann man mit Bergwanderungen vergleichen: Man wird in der Regel den niedrigsten Pass erklimmen, um von einem in das nächste Tal zu gelangen. Hat man jedoch ein besonders lohnendes Ziel vor Augen, bemüht man sich auch schon mal über einen höheren Berg. Das Tunneln einer chemischen Reaktion kann man mit der Durchquerung eines hohen Berges von einem Tal zum nächsten durch einen – allerdings unsichtbaren – Tunnel verstehen. Bisher gingen Forscher davon aus, dass nur relativ niedrige Berge durchquert werden können und dass der Pfad über den Berg weiterhin gleichzeitig zugänglich ist.
Tunneleffekt mit dem Beamen vergleichbar
Die aktuelle Studie der Chemiker um Professor Peter R. Schreiner von der Universität Gießen und Professor Wesley D. Allen von der University of Georgia zeigt nun, dass beides keinesfalls Voraussetzung für dieses Phänomen ist. Der Tunneleffekt kann am einfachsten mit dem Beamen in einem Science Fiction-Film verglichen werden: Materie wird von einem Punkt zum anderen transportiert – vollkommen unabhängig davon, welche Hindernisse dazwischen liegen.
Das Tunneln haben führende Physiker bereits vor Jahrzehnten entdeckt. Es wurde jedoch sehr kontrovers diskutiert, da es kein klassisches Analogon gibt, sondern nur eine quantenmechanische Beschreibung möglich ist.
Methylhydroxycarben „gefangen“ und nachgewiesen
Die Entdeckung des Gießener Teams mit seinen US-amerikanischen Partnern basiert auf der erstmaligen Darstellung eines bisher unbekannten, kleinen Moleküls, dem Methylhydroxycarben (H3C–C–OH). Dieses Molekül wurde nach thermischer Erzeugung in einer Argonmatrix bei minus 263 Grad Celsius „gefangen“ und spektroskopisch nachgewiesen.
Das erhoffte Tunnelverhalten trat ein: Unerwartet – zumindest nach dem bisherigen Verständnis chemischer Reaktionen – wurde die stärkste Bindung im System, nämlich die zwischen Sauerstoff (O) und Wasserstoff (H) gebrochen.
Quantenmechanischer Tunnelprozess
Innerhalb weniger Stunden bildete sich den Forschern zufolge selbst bei dieser tiefen Temperatur ausschließlich das unwahrscheinlichste Produkt, nämlich Acetaldehyd (H3C–CHO). Es war also ein Wasserstoff-Atom vom Sauerstoff zum Kohlenstoff (C) gewandert. Da bei Temperaturen nahe dem absoluten Nullpunkt mangels Energie keine thermischen Reaktionen stattfinden können, konnte es sich nur um einen quantenmechanischen Tunnelprozess handeln.
„Wir wussten, dass die Reaktionsgeschwindigkeit durch Tunneln deutlich größer werden kann und dass dies bei niedrigen Temperaturen und leichten Atomen besonders zum Tragen kommt“, sagt Schreiner. „Was wir hier entdeckt haben, geht allerdings weit darüber hinaus. Der Tunnelprozess lenkt die Reaktion weg von dem durch die kinetische Kontrolle erwarteten Produkt – es bildet sich gerade eben nicht das Produkt mit der geringsten Barriere.”
Analogie zu Schrödingers Katze
Allen und Schreiner legen die Analogie zur berühmten Katze des Physikers Erwin Schrödinger nahe: Die Katze kann nicht aus dem Käfig springen, weil die Wände zu hoch sind. Stattdessen bricht sie durch die Wand hindurch, ohne die kleinste Verletzung davon zu tragen.
„Die Entdeckung des Methylhydroxycarbens war für uns schon ein Grund zur Freude, doch sein schnelles Verschwinden in Richtung Acetaldehyd war einer der seltenen ‚Heureka-Momente‘ in der Wissenschaft, in denen man plötzlich und unerwartet etwas Neues entdeckt, was noch deutlich interessanter ist, als die ursprüngliche Fragestellung“, so Schreiner.
Definition der Tunnelkontrolle
Die Aufklärung dieser neuen Befunde mittels einer Kombination ausgefeilter Experimente und extrem genauen Berechnungen führte schließlich zur Definition der Tunnelkontrolle, also einer nichtklassischen kinetischen Kontrolle einer chemischen Reaktion, in der die niedrigste Barriere nicht der entscheidende Faktor ist.
Die Wissenschaftler betonen, dass diese Ergebnisse weitreichende Konsequenzen für das Verständnis und das Design chemischer Reaktionen haben und nicht auf extrem tiefe Temperaturen beschränkt sind. (Science, 2011; doi:10.1126/science.1203761)
(Universität Gießen, 14.06.2011 – DLO)