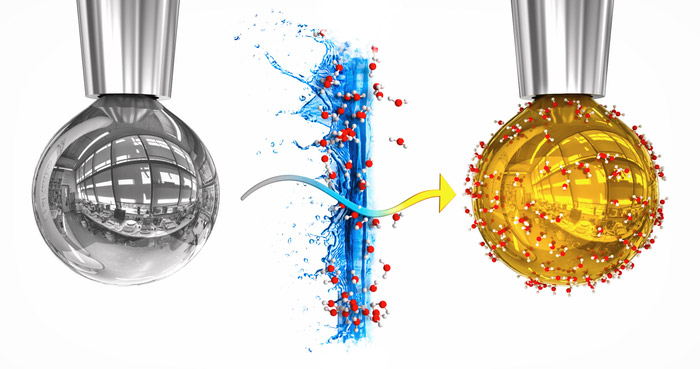
Wundersame Verwandlung: Forscher haben Wasser erstmals metallische Eigenschaften verpasst – ohne Hochdruck und bei Raumtemperatur. Gelungen ist dies durch einen raffinierten Trick: Sie ließen im Vakuum Wasserdampf auf einem Tropfen flüssiger Alkalimetalle kondensieren. Die Einwanderung von Elektronen aus dem Metall verlieh der dünnen Wasserschicht daraufhin kurzzeitig die Leitfähigkeit und das Aussehen eines Metalls: Der Tropfen bekam einen Goldglanz.
Metalle besitzen eine gute Leitfähigkeit, weil ihre delokalisierten Außenelektronen sich frei im Atomgitter bewegen können. Anders ist dies bei destillierten Wasser: Weil die Außenelektronen der beteiligten Atome fest gebunden bleiben, ist reines Wasser ein nahezu perfekter Isolator. Um es leitend und damit metallisch machen, müsste man die Wassermoleküle stark komprimieren. Der hohe Druck bringt dann die Orbitale der Außenelektronen so nah zusammen, dass sie überlappen. Durch die erhöhte Elektronendichte werden einige Elektronen mobil und erlauben so den Stromfluss.
Das Problem jedoch: „Im Fall des reinen Wassers wird der dafür nötige Druck auf 48 Megabar geschätzt – das ist jenseits unserer heutigen experimentellen Möglichkeiten und kommt wahrscheinlich nur im Kern von großen Planeten oder Sternen vor“, erklären Philip Mason von der Tschechischen Akademie der Wissenschaften in Prag und seine Kollegen. Tatsächlich spricht einiges dafür, dass Wasserstoff, Helium und möglicherweise auch Wasser im Inneren des Jupiter metallisch sein könnten.
Alkalimetalle und Wasser – eine heikle Kombination
Aber es geht auch anders, wie die Forscher jetzt in einem Experiment beweisen. Ausgangspunkt dafür war die Überlegung, dass man die Elektronendichte des Wassers auch durch eine Dotierung erhöhen könnte – indem man zusätzliche Elektronen aus einem anderen Material einschleust. Aus früheren Versuchen war zudem bekannt, dass sich Alkalimetalle dafür prinzipiell als Elektronengeber eignen würden.