Diese liegen normalerweise als inaktive Reservoirverbindungen vor, werden aber auf polaren Eiswolken in aktive Verbindungen umgewandelt, weshalb das Ozonloch auch alljährlich nur über den Polen entsteht. Jenes Rätsel nun, das Molina seinen Mitarbeitern aufgab, war die Frage, welche Eigenschaften der Polarwolken diesen zerstörerischen Prozess anstoßen.
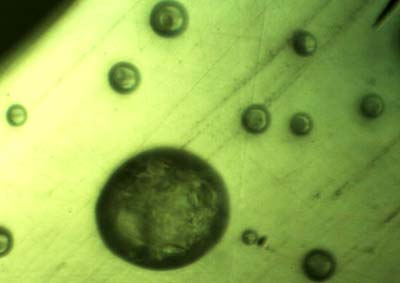
Mikrometer große Wassertropfen bei Temperaturen, wie sie in der polaren Stratosphäre herrschen (-80 bis -90 Grad Celsius). Im Inneren der Tröpfchen bilden sich Eiskristalle, die von einem flüssigen Mantel umgeben sind. © Universität Innsbruck
Flüssiger Mantel
„Die herkömmliche Theorie ging davon aus, dass die Kristalle in den polaren Eiswolken vollständig gefroren sind“, erzählt Lörting. „Wir haben damals schon untersucht, ob auch an deren Oberfläche Flüssigkeit vorhanden sein könnte.“ Aber erst vor kurzem ist es Lörting gemeinsam mit seinem Team gelungen, diesen Prozess im Labor zu simulieren. Dazu haben die Wissenschaftler Wassertröpfchen, die der chemischen Zusammensetzung in den Eiswolken entsprechen, langsam abgekühlt.
„Mit thermischen Analysen und im Mikroskop konnten wir beobachten, dass die Eiskristalle sich im Inneren der Tröpfchen bilden und auch bei minus 80 oder minus 90 Grad Celsius, der Temperatur der Stratosphäre über den winterlichen Polen, ein flüssiger Mantel erhalten bleibt“, schildert der Chemiker. „Dies hängt mit den chemischen Beimischungen zusammen: Die Wassertröpfchen enthalten Salpetersäure und Schwefelsäure, die nach der Bildung der Eiskristalle in der Flüssigkeit angereicht werden und wie ein Gefrierschutz wirken.“ Bisher hatte man angenommen, dass sich die Säuren im Inneren der Eiskristalle sammeln.
Eiswolken bilden Milieu für chemische Reaktionen
Die von Lörting und seinen Kollegen entdeckte Flüssigkeitsschicht auf den Eiskristallen bildet ein ideales Milieu für chemische Reaktionen und könnte die rasche Bildung der zerstörerischen Chlorverbindungen in den nur teilweise gefrorenen Tröpfchen der stratospherischen Wolken erklären. Wenn nach den kalten Polarnächten über den Polen die Sonne wieder aufgeht, verdampfen die Eiswolken und mit ihnen die aktiven Chlorverbindungen, die dabei das umgebende Ozon in Sauerstoff umwandeln und damit die Ozonschicht in der Stratosphäre zerstören, die uns vor dem UV-Licht schützt.
„Dies erklärt auch, warum andere Oberflächen, wie Staub, Ruß oder Salzteilchen nicht den gleichen Prozess in Gang setzen“, erläutert Lörting. „Es sind die spezifischen Bedingungen in den polaren Eiswolken, die die Zerstörung der Ozonschicht befördern.“
Wie kommt es zur Zerstörung der Ozonschicht?
In Zukunft will er mit seinem Team die eiskalten Tröpfchen noch genauer untersuchen. „Wir wollen zum Beispiel wissen, wie dick diese Flüssigkeitsschicht um die Eiskristalle wirklich ist und wie schnell chemische Reaktionen darin ablaufen können“, sagt der Chemiker. Dies könnte weiteren Aufschluss über den genauen Ablauf der chemischen Reaktionen geben und die Prozesse weiter erhellen, die zur Zerstörung der Ozonschicht führen.
(Universität Innsbruck, 01.02.2010 – DLO)
1. Februar 2010
















