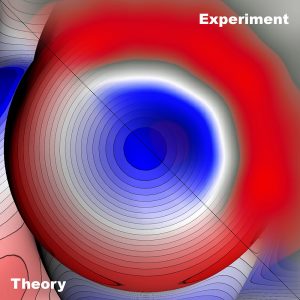
Unsichtbares sichtbar gemacht: Forscher haben erstmals die Struktur der sogenannten Halogenbindung sichtbar gemacht – einer Brückenbindung zwischen zwei elektronegativen Atomen, die sich eigentlich abstoßen müssten. Diese Bindung wird nur möglich, weil das Halogenatom eine ungleiche Elektronenverteilung entwickelt. Genau dieses „Sigma-Loch“ haben die Wissenschaftler nun erstmals direkt sichtbar gemacht und so die Theorie nach fast 50 Jahren bestätigt.
Neben den klassischen chemischen Bindungen, durch die Atome zu Molekülen werden, existieren in der Chemie noch weitere verbindende Kräfte in Form von Brückenbindungen. Sie verändern zwar nicht die chemische Natur der Atome, sind aber wichtig, um Moleküle oder Molekülverbände zu stabilisieren. Bei Wasserstoffbrückenbindungen sorgen dabei Ladungsverschiebungen innerhalb der Moleküle dafür, dass zwischen den beteiligten Atomen eine Anziehung entsteht.
Brückenbindung statt Abstoßung
Doch es gibt noch eine Form der Brückenbindung, die lange Zeit Rätsel aufgab. Denn diese sogenannte Halogenbindung widerspricht auf den ersten Blick allen Regeln der Chemie. Bei ihr entsteht die Kopplung nicht zwischen Atomen mit unterschiedlichen Teilladungen, sondern zwischen zwei stark elektronegativen Atompartnern. „Der enge Kontakt zwischen diesen Atomen müsste theoretisch eine elektrostatische Abstoßung bewirken“, erklären Teamleiter Pavel Jelinek vom CATRIN-Forschungszentrum in Prag und seine Kollegen.
Seltsamerweise bleibt die Abstoßung aber aus und Halogen-Atome wie Brom, Chlor oder Iod bilden Brückenbindungen mit elektronegativen Partnern. Eine Erklärung für diese „unmögliche“ Bindung lieferte schon vor fast 50 Jahren die Theorie eines „Sigma-Lochs“. Nach dieser verschieben sich die Elektronenorbitale des Halogenatoms so, dass sie einen negativen Ring bilden. Dadurch entsteht am „Pol“ des Atoms eine positive Zone, die die Bindung mit einem negativen Partner ermöglicht – das Sigma-Loch.