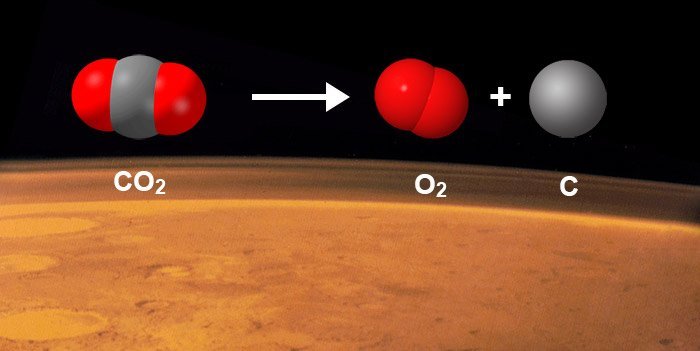
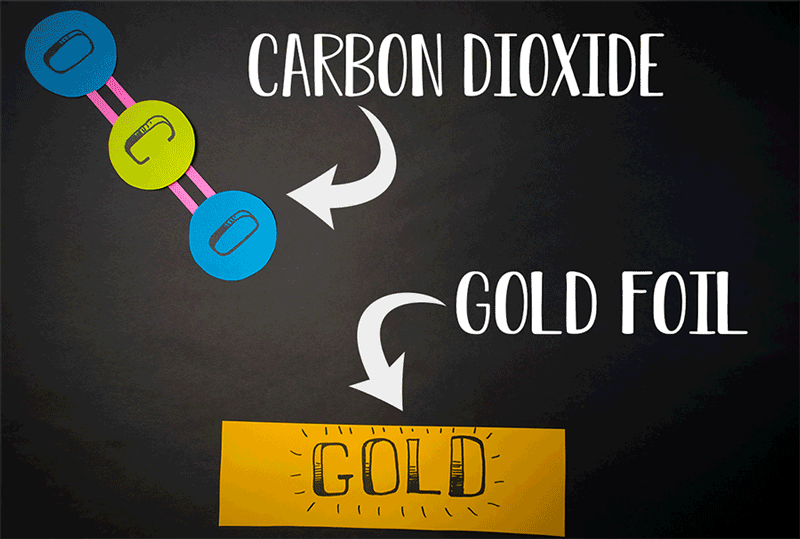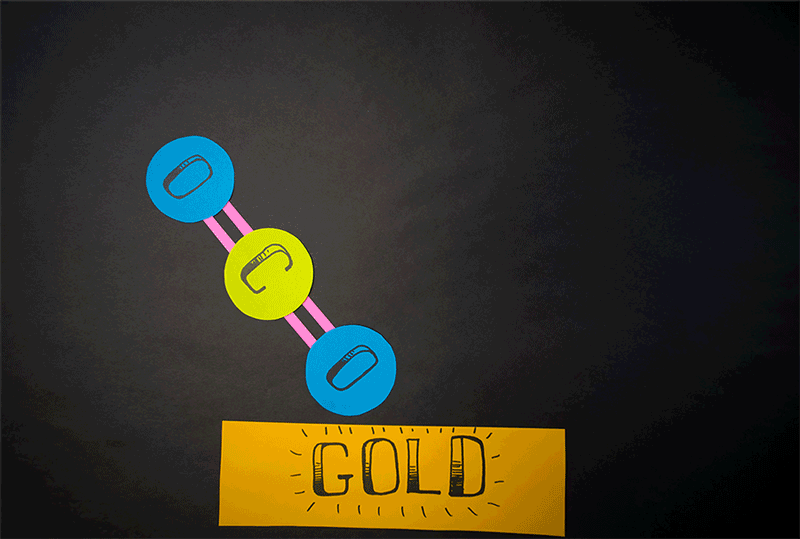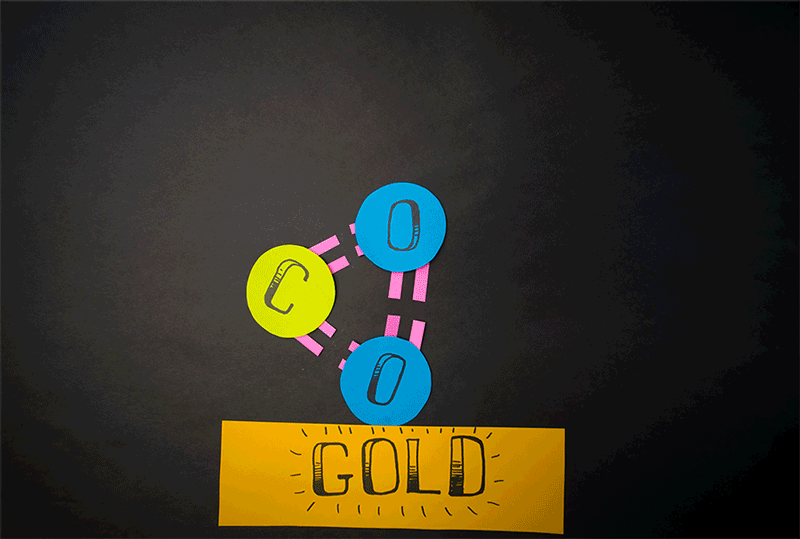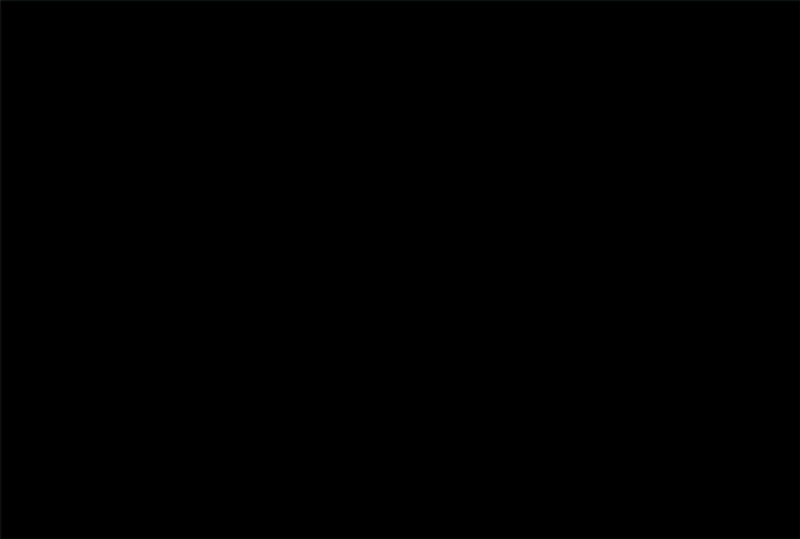Eine dieser Reaktionen wäre theoretisch der direkte Zerfall von CO2 in O2 und ein Kohlenstoff-Atom. Modelle legen nahe, dass Kollisionen schneller Gasmoleküle – beispielsweise in der Hülle eines Kometen – genügend Energie für diese Dissoziation liefern könnten. Das Problem jedoch: „Diese Reaktion erfordert umfassende molekulare Umlagerungen im CO2-Molekül“, erklärt Yaos Kollege Konstantinos Giapis. Weil das CO2-Molekül linear ist, müsste man es extrem verbiegen, um die beiden Sauerstoffatome in Kontakt zu bringen.
Gold unter CO2-Beschuss
„Wir dachten deshalb, dass es unmöglich ist, die beiden Sauerstoffatome eines CO2-Moleküls auf diese Weise zu verbinden“, sagt Giapis. „Man muss schließlich etwas ziemlich Drastisches mit diesem Molekül veranstalten.“ Dennoch machten die Forscher die Probe aufs Exempel und schossen einen Strom von CO2-Molekülen im Vakuum auf eine Goldfolie. Das reaktionsträge Gold stellte sicher, dass der Untergrund bei dieser Kollision auf keinen Fall selbst Sauerstoff freisetzen oder als Reaktionspartner dienen konnte.
Das Ergebnis: Ein Teil der CO2-Moleküle zerfiel komplett in seine Einzelatome oder zu Kohlenmonoxid und atomarem Sauerstoff. Ein kleiner Teil jedoch wandelte sich tatsächlich in O2 um – ohne dass Katalysatoren oder mehr als nur die Aufprallenergie dafür nötig waren. Allein durch die Kollision produzierte der CO2-Einstrom ein bis zwei Prozent molekularen Sauerstoff, wie die Forscher berichten.
Zum Dreieck verbogen
Wie war diese scheinbar unmögliche Umwandlung möglich? Analysen mithilfe der Beobachtungsdaten und physikalischen Modellen enthüllten, was nach dem Aufprall im Kohlendioxid-Molekül geschieht. „Als erstes kollidiert das führende Sauerstoffatom mit einem Goldatom des Untergrunds, dann folgt der Aufprall des CO-Molekülrests“, erklären Yao und sein Team. In den meisten Fällen wird dadurch das führende Sauerstoffatom abgesprengt und es entsteht Kohlenmonoxid.
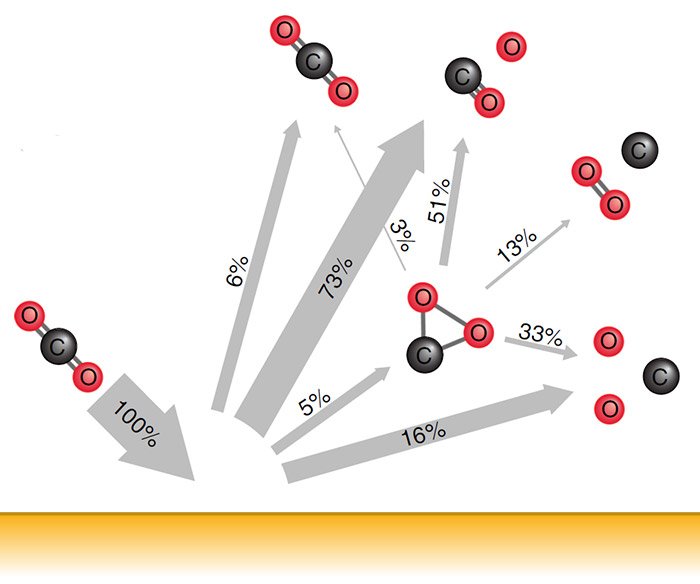
Anteile verschiedener Reaktionsprodukte nach der Kollision von CO2 mit einer Goldoberfläche. © Yao et al. /Nature Communications, CC-by-sa 4.0 Doch in fünf Prozent der Kollisionen bleibt das CO2-Molekül zunächst intakt, verformt sich aber extrem. „Im Verlauf dieser intramolekularen Reorganisation bekommt das CO2 eine dreieckige Konfiguration mit nahezu gleichen Bindungslängen zwischen den Atomen“, berichten die Forscher. Dadurch kommen sich beide Sauerstoffatome sehr nahe und es kommt zur Bindungsumlagerung: „Das Molekül dissoziiert zu einem freien Kohlenstoffatom und einem O2-Molekül“, so Yao und sein Team.
Zuvor unbekannter Reaktionsweg
Damit haben die Forscher eine ganz neue Variante der CO2-Dissoziation entdeckt – und einen direkten Weg, um aus CO2 molekularen Sauerstoff zu gewinnen. „Dieser Prozess beinhaltet einen zuvor unbekannten intramolekularen Reaktionsweg, der überraschend unabhängig von der Art und Temperatur der Kollisions-Oberfläche ist“, sagen die Wissenschaftler. Um die Reaktion auszulösen, reicht es, die Gasmoleküle zu beschleunigen und auf ein Hindernis prallen zu lassen.
„Mit genügend Tempo könnte man sogar einen Stein in etwas CO2 werfen und man würde das Gleiche erzielen – der Stein müsste nur etwa so schnell sein wie ein Komet oder Asteroid im All“, erklärt Giapis. „Diese Reaktion könnte daher für astrophysikalischen Umgebungen wie Kometen, Monde und Planeten mit CO2-Atmosphären relevant sein.“ Dieser Zerfallsweg könnte auch erklären, woher der molekulare Sauerstoff in der Gashülle von Churyumov-Gerasimenko stammt.
Atemgas für Mars-Astronauten?
Die Reaktion könnte sich aber auch ganz praktisch nutzen lasen, wie die Forscher erklären – beispielsweise von künftigen Astronauten auf dem Mars. Sie könnten mithilfe dieser Dissoziation Atemgas aus der CO2-Atmosphäre des Roten Planeten erzeugen. Noch ist die Ausbeute an Sauerstoff dafür allerdings zu gering, wie auch die Wissenschaftler einräumen: „Ist dies schon ein Gerät, mit dem wir das Sauerstoffproblem auf dem Mars lösen können? Nein! Aber es ist eine Methode, die etwas sehr Schwieriges kann“, so Yao und seine Kollegen.
Und durch eine Kombination mit anderen Reaktionswegen könnte der neu entdeckte Reaktionsweg selbst auf dem Mars einmal nützlich werden. (Nature Communications, 2019: doi: 10.1038/s41467-019-10342-6)
Quelle: California Institute of Technology
3. Juni 2019
- Nadja Podbregar