Die meisten Bindungen in der Natur beruhen auf der elektrostatischen Anziehung zwischen verschiedenen Teilchen: Dies reicht vom einfachen Kochsalz bis zu den Kräften, die es beispielsweise Insekten ermöglichen, an der Decke zu laufen. Deutsche Forscher haben jetzt ein neuartiges Molekül erzeugt, das ebenfalls von diesen Kräften zusammengehalten wird und aus zwei Atomen vom selben Element besteht.
Über den ein wenig exotischen Neuling berichten die Wissenschaftler des 5. Physikalischen Instituts der Universität Stuttgart in der aktuellen Ausgabe des Wissenschaftsmagazins „Nature“. In diesem neuartigen Molekül ist eines der beiden Atome hoch angeregt: Sein äußerstes Elektron kreist auf einer Bahn mit sehr großem Durchmesser und ist nur noch schwach an den Rest des Atoms gebunden. Man bezeichnet diese hochangeregten Atome nach ihrem schwedischen Entdecker Johannes Rydberg als Rydberg-Atome und das zugehörige Elektron auch als Rydberg-Elektron. Das zweite Atom des Moleküls befindet sich im Grundzustand.
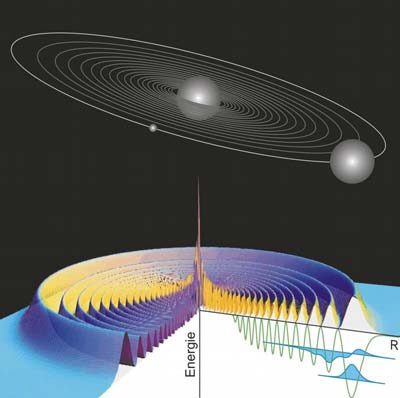
Das Besondere an diesem Molekül ist sein Bindungsmechanismus: Er beruht ausschließlich auf dem Einfluss des Rydberg-Elektrons auf das zweite Atom. Es wird im elektrischen Feld des Elektrons polarisiert und dadurch an das Rydberg-Atom gebunden. Die Größe des Moleküls wird deshalb direkt durch die Umlaufbahn des Rydberg-Elektrons bestimmt. Damit zählt dieses Molekül mit einem Durchmesser von mehr als 100 Nanometern zu den größten bekannten zweiatomigen Molekülen.
„Verschmierte“ Elektronen
Strenggenommen bewegen sich die Elektronen in einem Atom nicht auf Kreisbahnen, sondern sind entsprechend einer räumlichen Verteilung „verschmiert“. In der Quantenmechanik wird diese durch die Wellenfunktion beschreiben. Vom Zentrum des Atoms ausgehend besitzt diese Verteilung abwechselnd Maxima und Minima. Dort, wo das Maximum am größten ist, ist auch die Wahrscheinlichkeit am größten, das Elektron anzutreffen. Genau hier liegt die klassische Bahn des Elektrons.
Damit sich das neu entdeckte Molekül bilden kann, muss sich genau in diesem Abstand ein Atom im Grundzustand befinden. Da die Atome in einem Gas bei Zimmertemperatur viel größere Abstände voneinander haben und sich außerdem mit Schallgeschwindigkeit bewegen, benutzten die Physiker aus dem Team von Tilman Pfau ein ultrakaltes Gas aus Rubidiumatomen und bestrahlten dieses mit Laserlicht. Dadurch wurde das äußere Elektron von einigen Rubidiumatomen auf eine sehr große Bahn „gehoben“ und es konnten Rydberg-Atome erzeugt werden.
Charakterisierung der Moleküle
Wie lässt sich aber kontrollieren, ob dabei wirklich ein Molekül entstanden ist? Bei der Entstehung der meisten Moleküle kann der Übergang von freien Atomen zu Molekülen direkt an veränderten Eigenschaften beobachtet werden. Die Eigenschaften des neuartigen Rydberg-Moleküls werden jedoch hauptsächlich vom Rydberg-Atom bestimmt. Wegen dieser Ähnlichkeit von Atom und Molekül scheidet der konventionelle Nachweis aus.
Deshalb untersuchten die Forscher um Tilman Pfau den Prozess, der zur Bildung der Moleküle führt. Für die Anregung eines Atoms in einen Rydberg-Zustand wird eine charakteristische Energie des Laserlichts benötigt. Erzeugen sie aber ein Molekül, so ändert sich diese Energie: Sie ist genau um die Bindungsenergie des Moleküls kleiner. Um also zu prüfen, ob es sich um ein Molekül oder ein einfaches Rydberg-Atom handelt, haben die Physiker die Energie ihres Lasers in kleinen Schritten verändert und die Anzahl der entstandenen Rydberg-Atome gemessen. Durch diese Methode, bei der sie die Energie ihres Lasers mit einer Genauigkeit von eins zu einer Milliarde kennen, konnten sie das neuartige Molekül erzeugen und gleichzeitig seine Bindungsenergie bestimmen.
Neuer Bindungsmechanismus nachgewiesen
Der erstmalige Nachweis dieses neuen Bindungsmechanismus ist nach Aussagen der Forscher eine wichtige Bestätigung einer Theorie, die diese Art von Molekülen bereits im Jahr 2000 vorhergesagt hat. Daneben haben die Physiker an diesen Molekülen aber auch den Einfluss eines Elektrons auf das Grundzustandsatom sehr isoliert studiert und erstmals quantifiziert. Damit konnten sie wichtige quantenmechanische Eigenschaften des Elements Rubidium bestimmen.
Grundsätzlich können diese Moleküle nicht nur aus Rubidium, sondern aus allen Elementen gebildet werden, für die die Kraft durch ein Elektron anziehend ist, wie etwa bei den anderen Alkalimetallen. Damit ist dieser Bindungstyp auf eine Vielzahl von chemischen Elementen übertragbar.
(idw – Universität Stuttgart, 23.04.2009 – DLO)