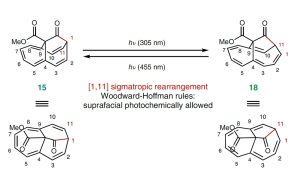
Nach gut 70 Jahren erstmals nachgewiesen: Deutsche Chemiker haben zum ersten Mal eine sogenannte neutrale homoaromatische Verbindung erzeugt. Diese organischen Moleküle haben ähnlich wie Benzol und andere aromatische Kohlenwasserstoffe delokalisierte Bindungselektronen, ihr Ring ist aber nicht geschlossen. Die Synthese dieser homoaromatischen Verbindungen eröffnet nun neue Möglichkeiten, diese exotische Molekülklasse zu erforschen, und hat auch Potenzial für praktische Anwendungen.
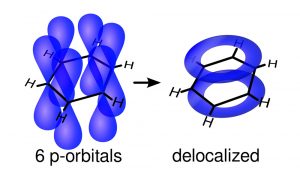
Aromatische Verbindungen sind ringförmige Moleküle, in denen die Bindungselektronen zwischen den Atomen nicht fest zugeordnet sind – sie bilden delokalisierte Orbitale, die um den gesamten Ring herumreichen. Dies ist meist dann möglich, wenn sich Einfach- und Doppelbindungen zwischen den Atomen abwechseln, wie im Benzolring der Fall. Nach der sogenannten Hückel-Regel muss eine aromatische Verbindung zyklisch und planar sein und (4n + 2) delokalisierte π-Elektronen besitzen.
Schätzungen zufolge sind rund zwei Drittel aller bekannten chemischen Verbindungen ganz oder teilweise aromatisch. Neben vielen organischen Kohlenwasserstoffen haben Chemiker auch Aromaten aus Metallatomen und kürzlich sogar erstmals aus sechs Stickstoffatomen erzeugt.
Delokalisierte Elektronen trotz Lücken im Ring
Doch theoretischen Modellen zufolge gibt es eine weitere Molekülklasse mit delokalisierten π-Elektronen: die sogenannten homoaromatischen Verbindungen. Bei diesen wechseln sich Einfach- und Doppelbindungen nicht regelmäßig ab, dadurch ist der Ring aus π-Orbitalen nicht geschlossen. Trotzdem können die eigentlich räumlich getrennten π-Elektronen in solchen homoaromatischen Molekülen miteinander wechselwirken und die Lücke überwinden – sie bauen ein Kreissystem auch ohne passende Bindung auf.